Введение
Зрелость легких плода имеет жизненно важное значение для выживания новорожденных детей и определяет их внеутробную жизни. Респираторный дистресс синдром (РДС) и связанные с ним осложнения вызывают смерть новорожденных в 28% случаев
Однако, широкое пренатальное применение глюкокортикоидов уменьшили заболеваемость РДС. Точная оценка дородовой зрелости легких плода, особенно во время беременности с высокой степенью риска, имеет решающее значение для улучшения неонатального выживания.
Идентификация фосфолипидов в амниотической жидкости, включая фосфатидилглицерол, фосфатидилэтаноламин и соотношение лецитин/сфингомиелин (L/S соотношение), является основным методом определения дородовой зрелости легких, который широко применяется в медицинской практике.
С 1980-х годов многие исследовали использование ультразвука для контроля зрелости легких плода. Исследование эхогенности легких плода, дыхательноподобных движений плода, допплеровского спектра, связанного с назальным потоком жидкости при дыхательноподобных движениях плода (BRNFF) и данные объема легких связаны с анализом зрелости легких плода, однако до сих пор нет единого набора сонографических критериев.
В Китае для ультразвукового исследования развития легких плода нет нормативного диапазона показателей, как определения объема легких, например. Таким образом, данное исследование было проведено (I) для оценки возможности и точности ультразвуковых показателей оценки зрелости легких плода; (II) установления границ нормы объема легких плода и сравнения эхогенности легких к эхогенности печени плода (FLLIR) в китайской популяции.
Лечение заболевания
Разработка адекватной тактики лечения пороков развития легких производится пульмонологами и торакальными хирургами. Она основывается на оценке состояния пациента и степени выраженности имеющихся нарушений.
Неотложное хирургическое вмешательство показано в случае выраженной дыхательной недостаточности при наличии аплазии и ангезии легких, лобарной эмфиземы, при трахеопищеводном свище и стенозах трахеи и бронхов.
При кистозной гипоплазии и бронхоэктазах выбор хирургического или консервативного метода лечения определяется количеством измененных сегментов в обоих легких, характером изменений легочной ткани, а также частотой рецидивов.
При распространенных изменениях в легких назначается консервативная терапия, нацеленная на предупреждение обострений гнойного процесса. Она заключается в ежегодных курсах противовоспалительной терапии, улучшении дренажа бронхиального дерева (назначение отхаркивающих и муколитических препаратов, бронхоальвеолярный лаваж, ингаляции, массаж, ЛФК) и санаторно-курортной реабилитации.
Наш сервис сотрудничает с одними из лучших специалистов в области лечения данной патологии. Напишите или позвоните нам для организации консультации у торакального хирурга высшей квалификационной категории, главного торакального хирурга Нижегородской области, зав. хирургическим торакальным отделением ГБУЗ НО «Городская клиническая больница № 5» Фурзикова Д. Л.
Лечение
Для выбора оптимального метода лечения необходимо записаться на приём к торакальному хирургу или к пульмонологу. Характер терапии определяется общим состоянием пациента, степенью проявления патологии, прогнозами на лечение. Немедленное хирургическое вмешательство требуется в следующих случаях выраженной дыхательной недостаточности:
- Лобарная эмфизема;
- Агенезия лёгких;
- Аплазия;
- Стеноз бронхов или трахеи;
- Трахеопищеводный свищ.
Наиболее распространённая методика лечения бронхоэктазов – удаление изменённой области органа, однако возможно и медикаментозное лечение, что зависит от количества рецидивов и объёма изменённой лёгочной ткани.
Также важно проведение консервативного лечения, которое позволяет предупредить развитие гнойных процессов: массаж грудной клетки, бронхоальвеолярный лаваж, ЛФК, ингаляции и др
Примеры множественных врожденных пороков развития (МВПР)
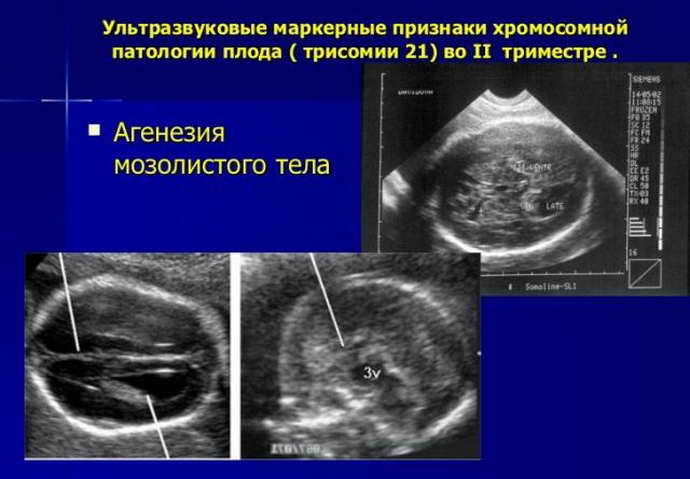
- Синдром Дауна. Развивается в результате трисомии по 21-й хромосоме. Пациенты имеют характерные черты лица, страдают задержкой умственного и речевого развития, у них нередко выявляется мышечная гипотония, катаракта, пороки сердца. Средняя продолжительность жизни составляет около 50 лет.
- Синдром Эдвардса. Данная разновидность множественных врожденных пороков развития (МВПР) обусловлена трисомией по 18-й хромосоме. У пациентов выявляется нарушение строения черепа, отсутствие или сужение слухового прохода, широкая грудная клетка, пороки сердечно-сосудистой системы, гипоплазия мозжечка, слабый тонус мускулатуры, судороги, тяжелая умственная отсталость. Характеризуется высокой летальностью.
- Синдром Марфана. Возникает при мутации в гене, который кодирует образование фибриллина. Данное соединение входит в состав практически всех эластичных волокон, поэтому у пациентов отмечается патология опорно-двигательного аппарата, органов зрения, сосудов. При регулярном и правильном лечении продолжительность жизни не снижается.
Другие виды множественных врожденных пороков развития (МВПР) оказывают существенное влияние на жизнедеятельность человека. При этом лечение возможно только симптоматическое, так как изменить дефекты в генах или хромосомах невозможно.
Методы диагностики
Диагностика множественных врожденных пороков развития (МВПР) может осуществляться дородовыми и послеродовыми способами. В первом случае проводятся скрининговые исследования, которые включают в себя УЗИ плода и анализ крови на специфические белки. Такое сочетание позволяет выявить большое количество множественных врожденных пороков развития (МВПР). Врач также может назначать дополнительные методы диагностики: биопсию ворсин хориона и амниоцентез. В этом случае получают не кровь матери, а материал плода, который затем отправляют на генетическое исследование.
ЗАДЕРЖКА РОСТА ПЛОДА, ГИПОТРОФИЯ НОВОРОЖДЕННОГО
Под задержкой роста плода (ЗРП) понимают несоответствие размеров плода предполагаемому сроку беременности.
ЗРП
наряду с хронической гипоксией, является одним из основных клинических
признаков хронической плацентарной недостаточности любого генеза (см.
раздел “Плацентарная недостаточность”, в главе 23). Помимо этого,
патология плода (врожденные аномалии развития), влияя на формирование
плаценты и на компенсаторно-приспособительные механизмы в системе
мать-плацента-плод, может служить причиной хронической плацентарной
недостаточности, и в следствие этого, – ЗРП.
Выделяют
две основные формы ЗРП, которые по данным УЗИ характеризуются
различными соотношениями показателей фетометрии: симметричная и
асимметричная.
Симметричная форма ЗРП, как правило,
развивается в ранние сроки беременности (первая половина) и может быть
обусловлена врожденной патологией, в том числе наследственными
заболеваниями и хромосомными аберрациями (трисомии по 18-й, 21-й, 13-й
паре хромосом, моносомии), инфекционными заболеваниями (краснуха,
токсоплазмоз, герпес, сифилис, цитомегаловирусная инфекция). Причинами
симметричной формы ЗРП могут быть курение, алкоголизм, наркомания, а
также недостаточное и неполноценное питание матери.
Асимметричная
форма ЗРП развивается в более поздние сроки (III триместр) и, как
правило, обусловлена либо экстрагенитальной патологией у матери
(гипертоническая болезнь, бронхиальная астма, аутоиммунные заболевания),
либо хронической плацентарной недостаточностью на фоне осложнений
беременности (гестоз, многоплодная беременность, длительная угроза
прерывания и т.д.).
Диагностика
Для качественного диагностирования порока необходимо проконсультироваться у пульмонолога насчёт проведения комплексного обследования. Подозревают наличие пороков у тех пациентов, которые с детства страдают хроническими заболеваниями лёгких и бронхов.
Наиболее эффективные методики обследования – бронхологическая и рентгенологическая.
Рентген лёгких и компьютерная томография позволяют выявить наличие порока даже при отсутствии клинической симптоматики, эти процедуры обеспечивают информацией об изменениях в бронхиальном и сосудистом рисунках, указывают на повышение прозрачности, смещение органов средостения, обнаруживают обратную топографию лёгких и др.
Бронхоскопия, а также бронхография позволяют оценить анатомические особенности строения бронхов и трахеи, обнаружить свищи, стеноз и другие дефекты строения, подтвердить изменения в бронхиальном дереве.
Если есть подозрение на пороки развития сосудов лёгкого, то требуется ангиопульмонография.
3.Симптомы и диагностика
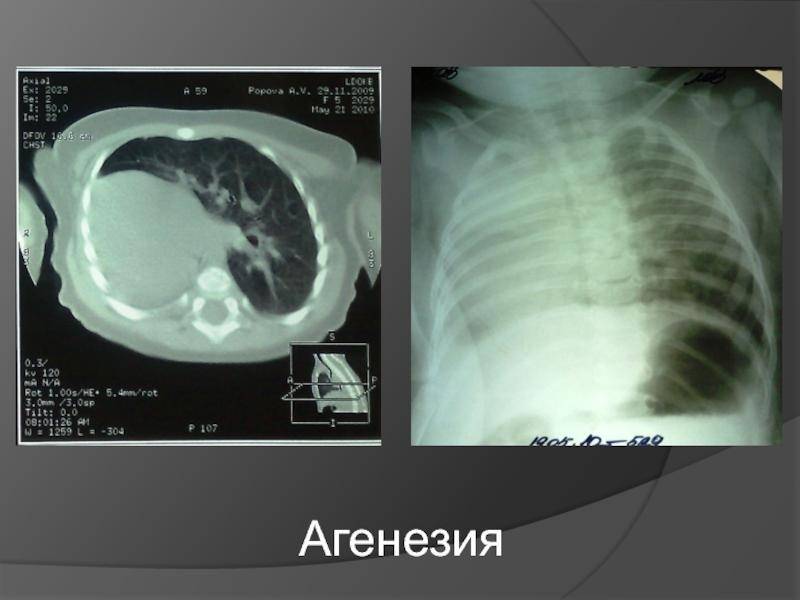
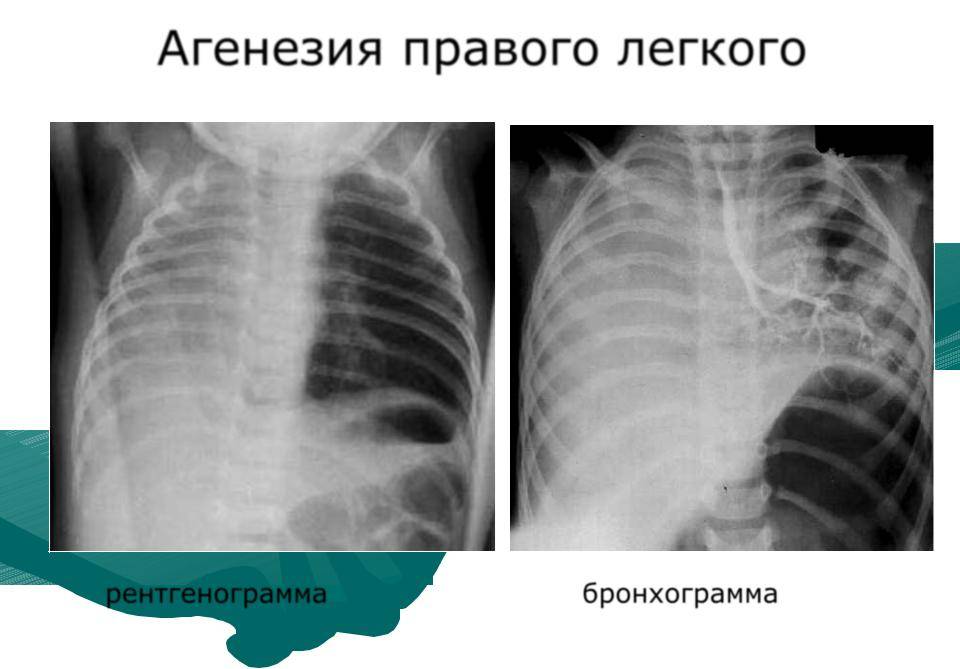
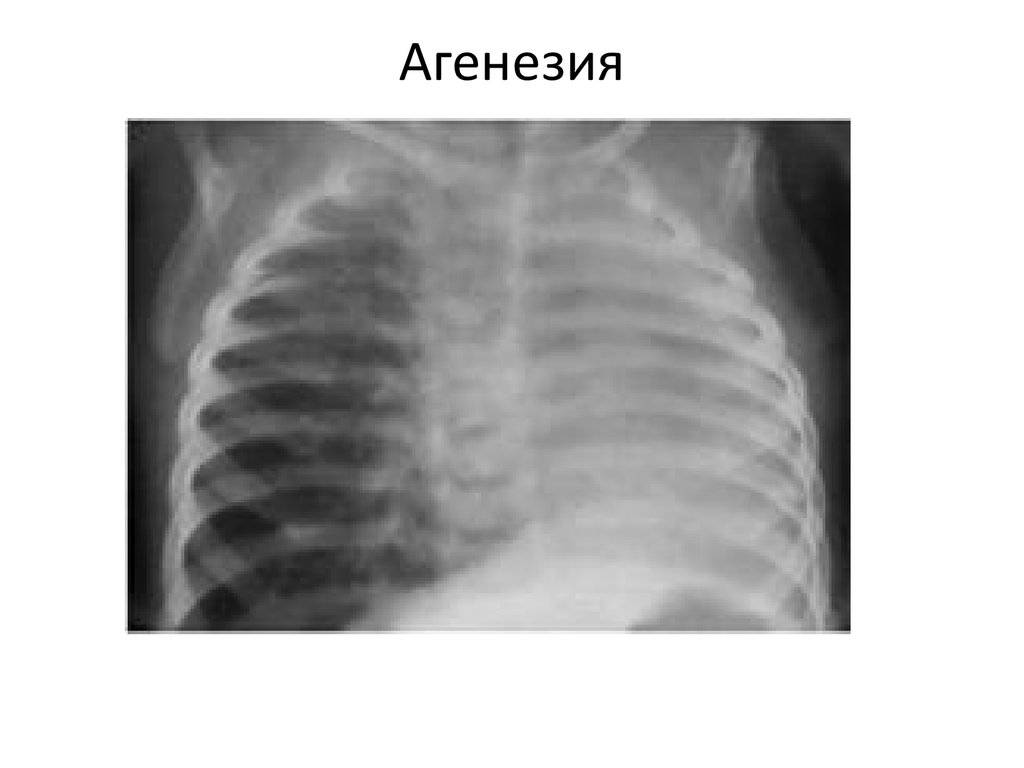
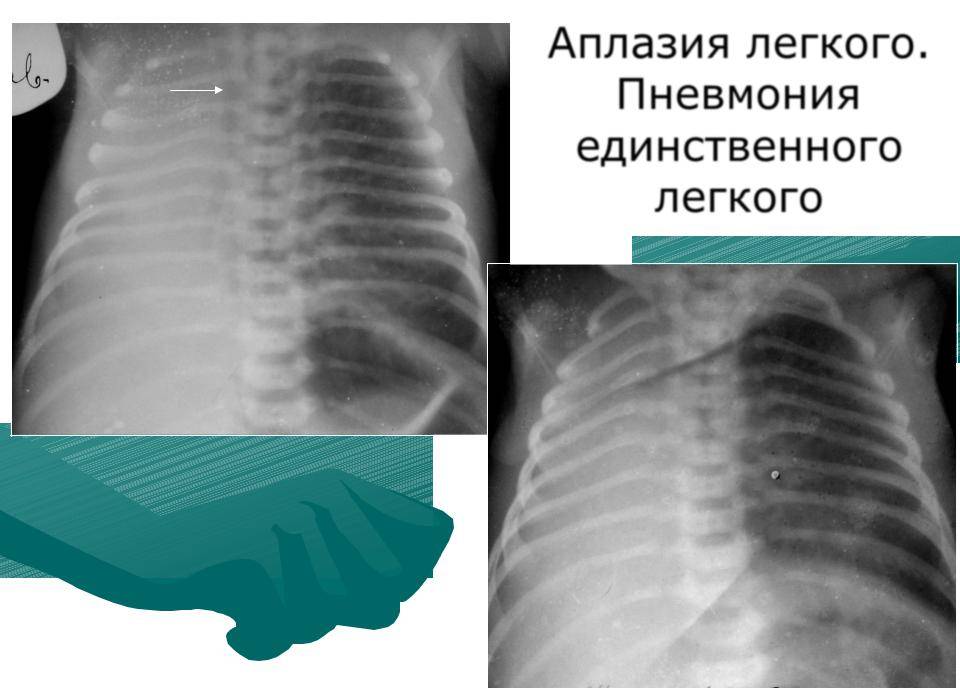
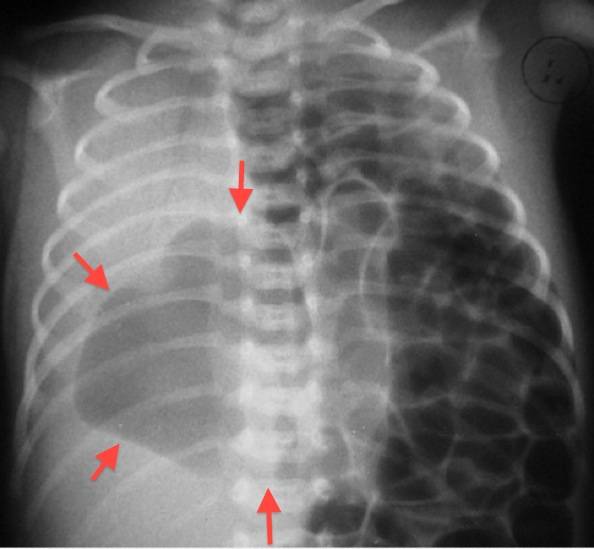
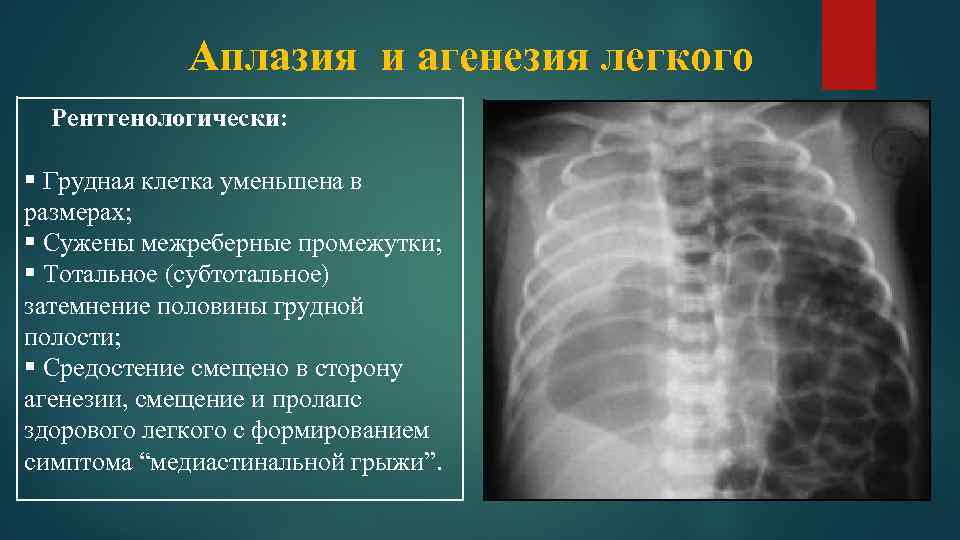
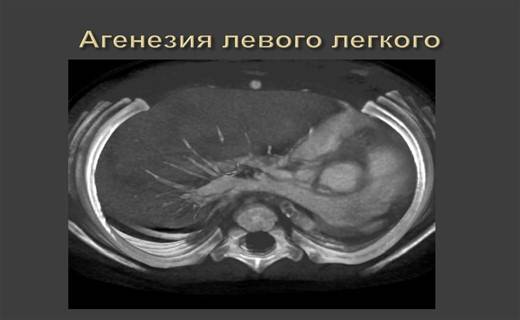
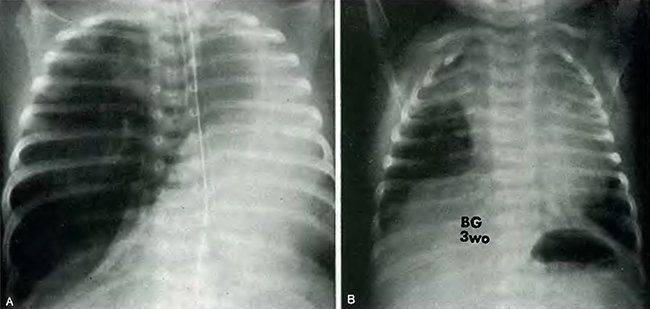
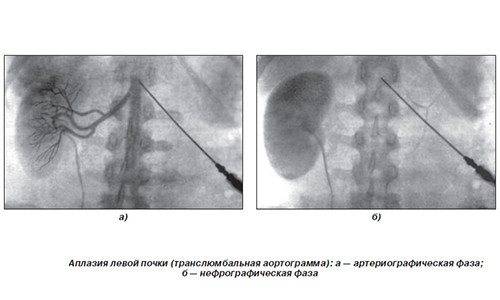
Двусторонняя агенезия несовместима с жизнью.
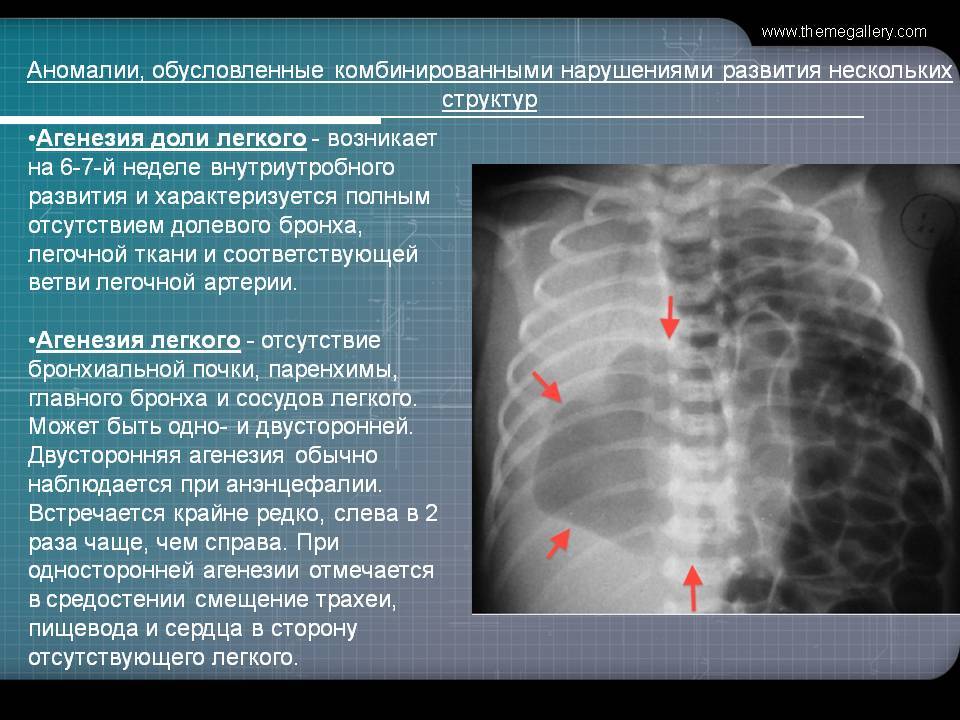
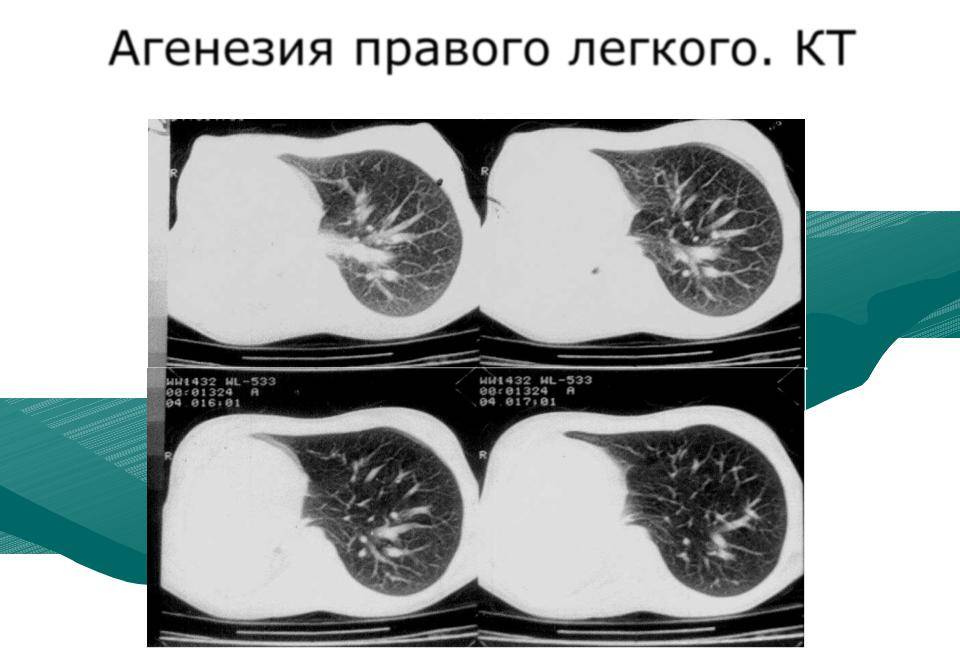
При односторонней чаще отсутствует левое легкое; нередко такая аномалия сочетается с другими пороками внутриутробного развития. Агенезия/аплазия легкого может длительное время протекать мало- или бессимптомно, однако она проявляется асимметрией дыхания при аускультации и притуплением звука при перкуссии. Смещение органов внутри грудной клетки, компенсаторное увеличение сохранного легкого может приводить к ее деформациям. В тяжелых осложненных случаях острая дыхательная недостаточность возникает непосредственно после рождения, быстро нарастает и заканчивается летально.
Гипоплазия клинически делится на две формы, простую и кистозную (врожденный поликистоз), при которой, как правило, имеет место хронический воспалительный процесс в дыхательной системе (с соответствующей симптоматикой).
Следует понимать, что столь серьезные аномалии, как агенезия, аплазия или гипоплазия легкого не может не сказываться на эффективности дыхания и газообменных процессов. В той или иной степени (от субклинической до критически тяжелой) дыхательная недостаточность присутствует во всех случаях; наличие порока отражается на качестве жизни, внося существенные ограничения, и является одним из факторов сокращения ее продолжительности.
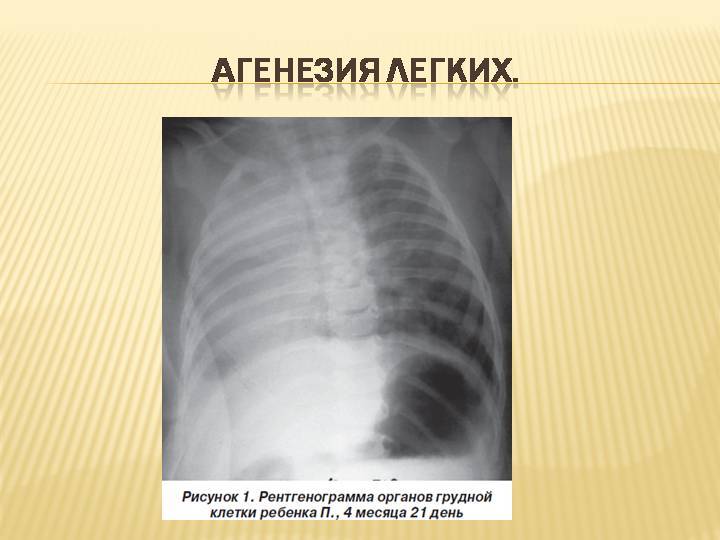
Агенезия и гипоплазия легкого может быть предположительно диагностирована уже при стандартном осмотре и аускультации. Такие пороки развития легко подтверждаются рентгенологически. Как правило, назначается также ангиопульмонография.
ГНОЙНО-СЕПТИЧЕСКИЕ ЗАБОЛЕВАНИЯ НОВОРОЖДЕННЫХ
Анатомо-физиологические
особенности, сниженная иммунная реактивность обусловливают высокую
восприимчивость новорожденных к гнойно-воспалительным инфекциям.
Инфицирование может наступить как во внутриутробном периоде, так и сразу
после рождения.
У новорожденных грань между
локальными и генерализованными формами гнойной инфекции в значительной
мере условна, так как возможен быстрый переход местного воспалительного
процесса в генерализованную инфекцию.
Клокальным формам относятся гнойно-воспалительные заболевания кожи и слизистых оболочек.
Кожа
новорожденных подвергается инфицированию наиболее часто. Различные
клинические формы поражения при этом объединяют под названием пиодермии.
Пиодермии развиваются под воздействием гноеродных микроорганизмов
(стафилококки, стрептококки, гонококки, протей, кишечная палочка,
синегнойная палочка и др.).
Везикулопустулез – поверхностная
стафилодермия новорожденных – встречается наиболее часто. Процесс
локализуется в устьях экзокринных потовых желез. Возникновению
заболевания могут способствовать перегревание, повышенная потливость,
мацерация. Фолликулярные пустулы размером с просяное зерно или горошину
располагаются по всему кожному покрову, чаще локализуются на спине, в
складках, на коже шеи, груди, в области ягодиц и на волосистой части
головы. Лечение местное (бриллиантовая зелень, метилвиолет, 2% раствор
перманганата калия). Антибактериальная терапия, как правило, не
проводится.
Псевдофурункулез – заболевание
мерокринных потовых желез у детей грудного возраста (множественные
абсцессы потовых желез, псевдофурункулез Фингера). Развитию заболевания
способствуют недоношенность, иммунодефицитные состояния, искусственное
вскармливание, дефекты ухода, повышенная потливость. Высыпания чаще
всего располагаются на затылке, спине, ягодицах, бедрах, возможно
распространение на кожу груди и живота. Заболевание сопровождается
нарушением общего состояния с повышением температуры тела. Местное
лечение осуществляют 2% спиртовыми или водными растворами анилиновых
красителей, присыпками из окиси цинка (10 %) с тальком. По показаниям
назначают антибиотики (с учетом данных антибиотикограммы) и
иммунозаместительную терапию.
1.Общие сведения
Бронхолегочная система человека очень сложна и начинает формироваться на самых ранних сроках беременности: т.н. дыхательная трубка закладывается на 3-4 неделе. Развитие органов дыхания продолжается в течение практически всего периода гестации, до 6-8 месяцев, когда заканчивается формирование тканей альвеол (а окончательно бронхолегочная система формируется только к 9-10 году жизни). Очевидно, что на столь продолжительном отрезке внутриутробного развития под влиянием всевозможных вредоносных воздействий или хромосомных аберраций эмбриогенез легких может существенно исказиться, замедлиться или даже остановиться. Это приводит к формированию различных пороков развития: классификация лишь наиболее частых врожденных аномалий бронхолегочной системы насчитывает около двух десятков форм.
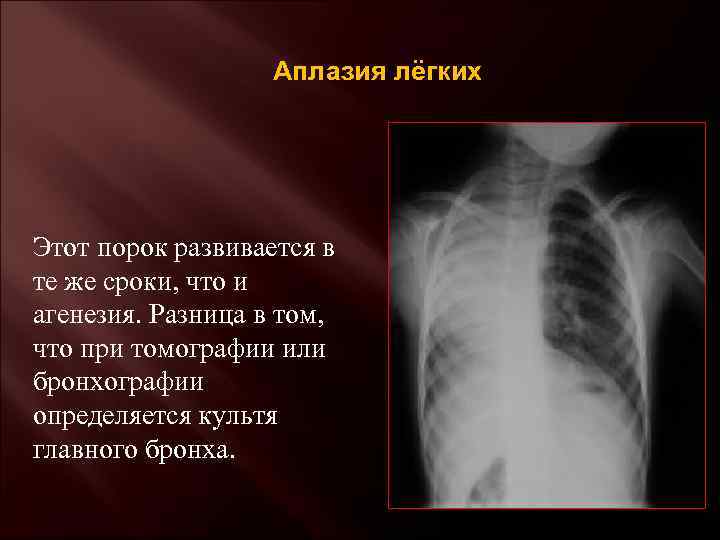
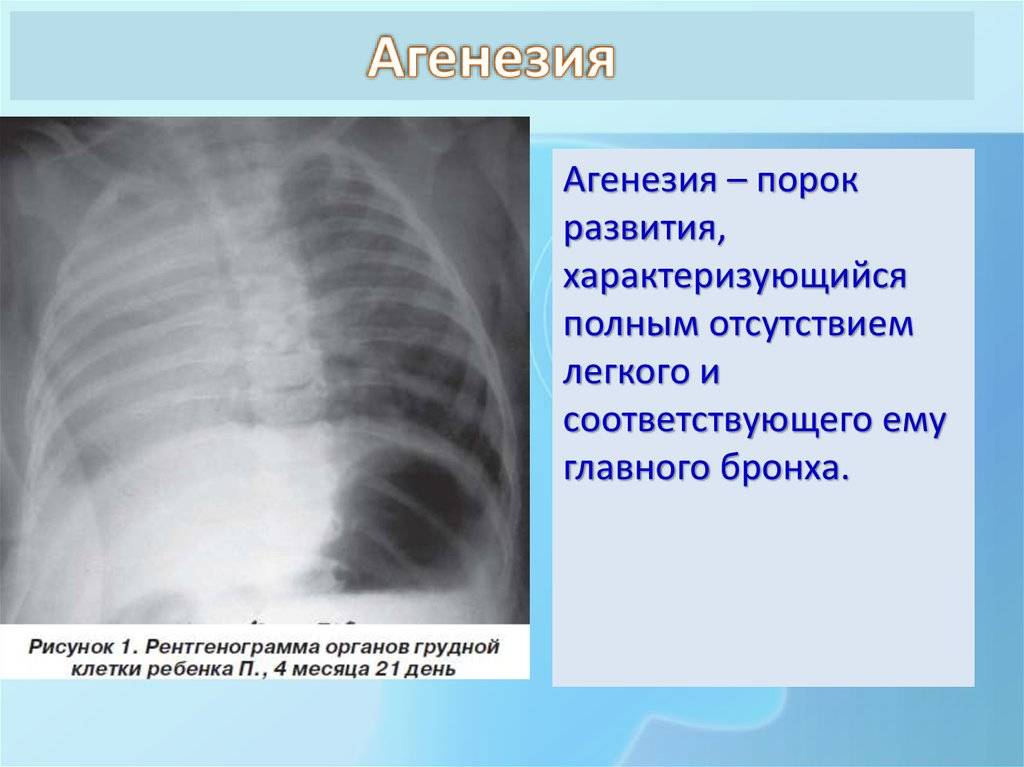
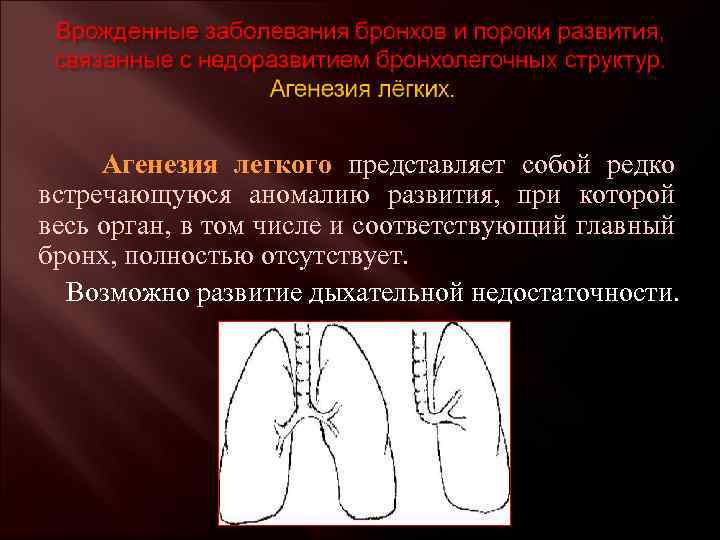
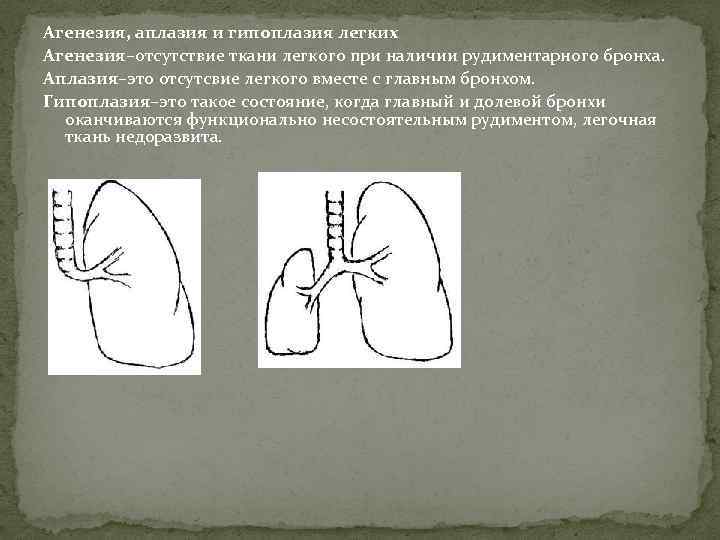
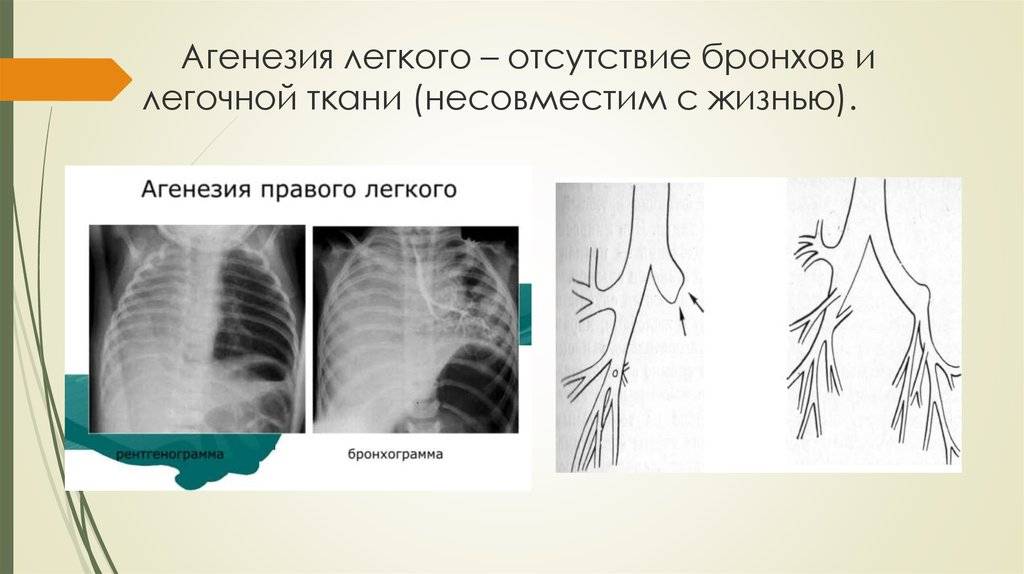
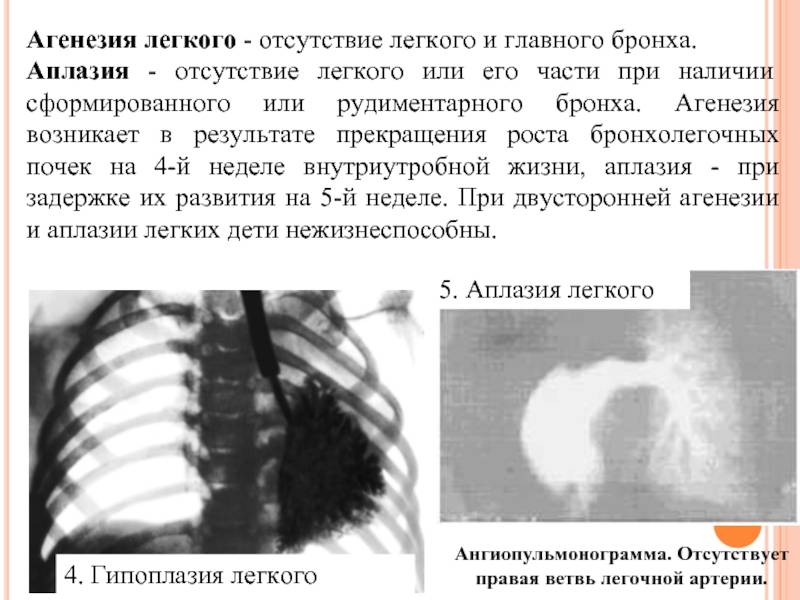
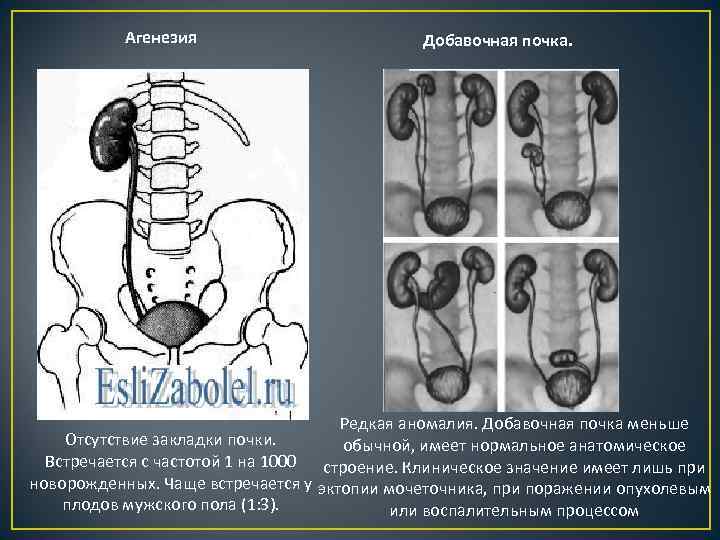
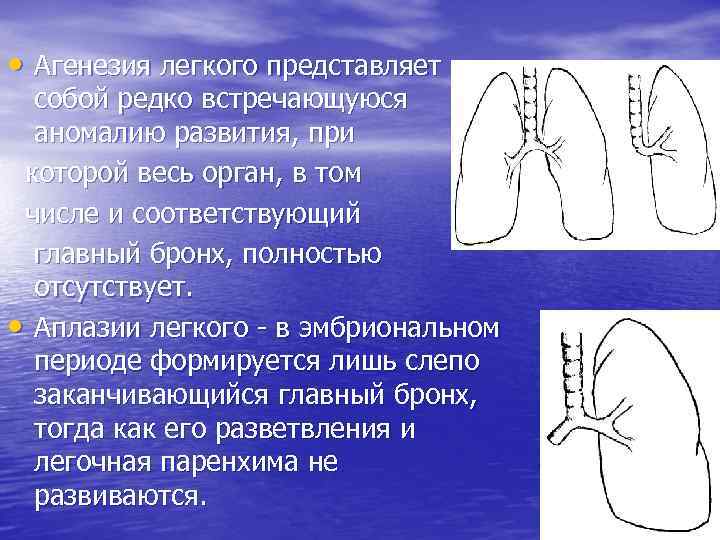
Агенезия, аплазия и гипоплазия легкого представляют собой один из наиболее тяжелых вариантов такой аномалии.
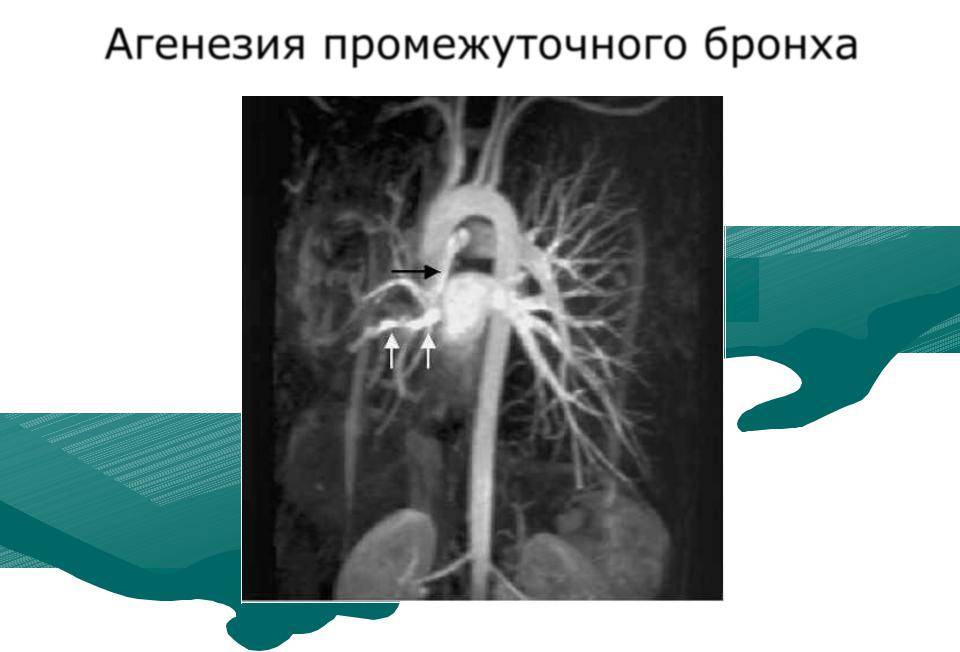
Агенезия и аплазия многими авторами описывается как единый тип врожденного порока развития (под общим названием агенезия), поскольку разница между ними несущественна и не создает различий в функциональном статусе, клинике или прогнозе. При собственно агенезии полностью отсутствует легкое и главный бронх; при аплазии успевает сформироваться слепая культя главного бронха, однако бронхиального древа и легкого в грудной клетке нет.
Агенезия/аплазия встречается редко, а двусторонняя – крайне редко. Более точная статистическая оценка на сегодняшний день не представляется возможной; вообще, распространенность всех пороков развития бронхолегочной системы в разных источниках оценивается чрезвычайно вариативно – в диапазоне примерно от 5% до 30% новорожденных.
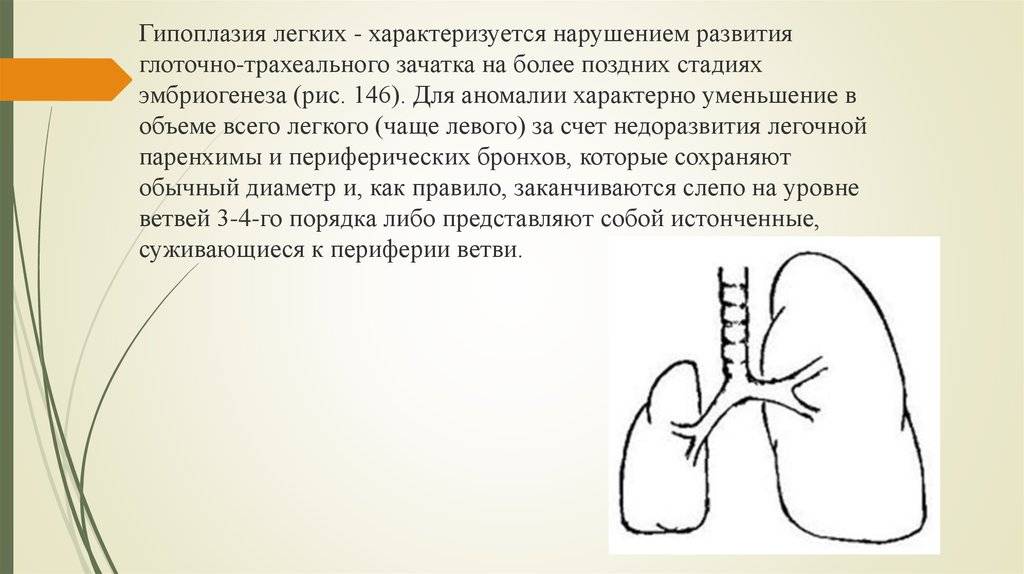
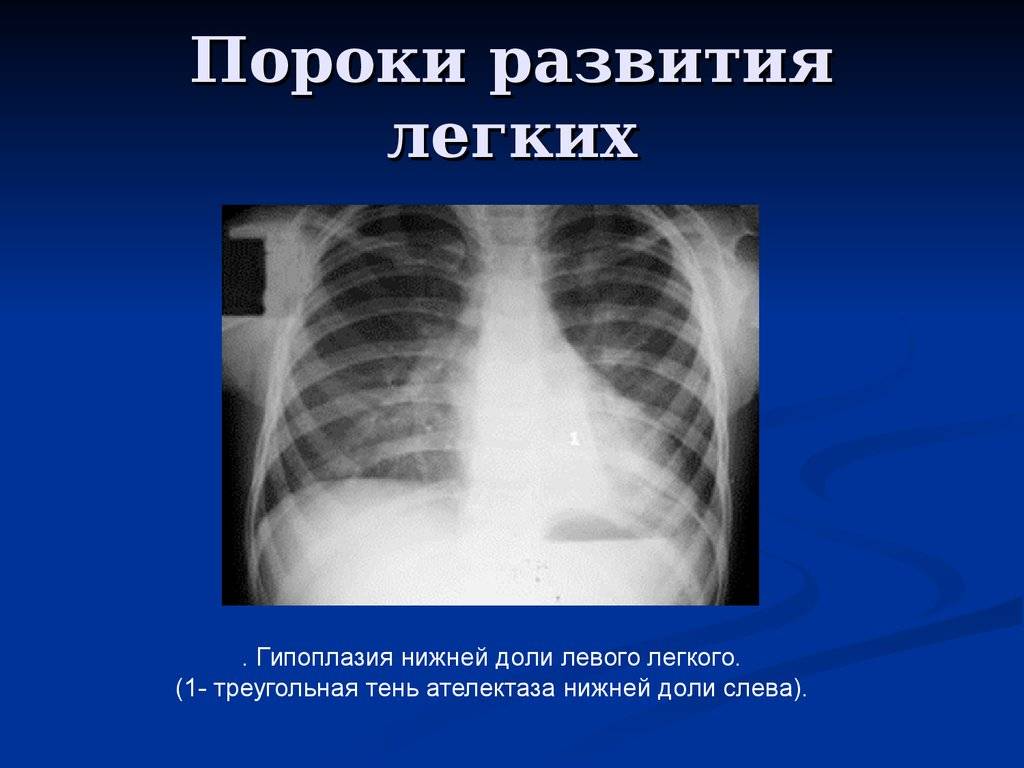
Гипоплазия легкого или отдельной его доли встречается чаще полной агенезии и представляет собой структурное и/или тканевое недоразвитие.
Диагностика заболевания
Диагностирование пороков развития легких проводится в процессе комплексного специализированного обследования. В группе риска находятся пациенты, с детства страдающие стойкими хроническими бронхолегочными заболеваниями. Главным инструментом диагностики пороков развития легких являются бронхологическое и рентгенологическое исследования.
Рентгенологическое исследование помогает выявить пороки развития легких даже в случае их бессимптомного течения. По результатам рентгенографии и КТ легких можно определить, например:
- изменения сосудистого и бронхиального рисунка в случае гипоплазии
- повышение прозрачности в случае лобарной эмфиземы
- смещение органов средостения при агенезии или гипоплазии
- обратную топографию легких при наличии синдрома Картагенера
На бронхографии и бронхоскопии проводится оценка анатомического строения бронхов и трахеи, выявляются деформации (свищи, стеноз) и изменения бронхиального дерева.
При пороках развития сосудов легкого назначается проведение ангиопульмонографии.
Виды
Пороки развития лёгких представляют собой обширную группу патологий, которые различаются по ряду признаков.
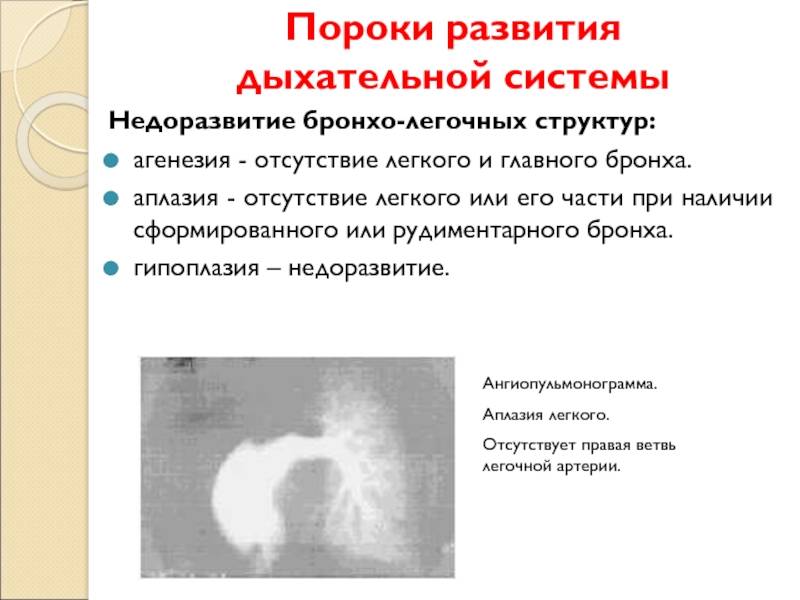
По уровню недоразвития органа дыхания, либо его составных частей различают:
- Агенезию – полное отсутствие лёгкого и его главного бронха;
- Аплазию – полное или частичное отсутствие лёгкого, при котором остаётся культя лавного бронха;
- Гипоплазию – недоразвитие группы составных элементов в органе дыхания, которое охватывает всё лёгкое, его долю или только сегмент.
Также различают пороки по их локализации и характеру:
- Пороки стенок трахеи и бронхов;
- Ограниченные дефекты строения стенок трахеи и бронхов;
- Наличие избыточных структур в органах дыхания (доля, лёгкое, кисты);
- Аномальное расположение структур органов дыхания;
- Пороки кровеносных сосудов.
Патологии плода, вызванные алкогольной зависимостью беременной
Самая распространённая патология, вызванная употреблением алкоголя беременной женщиной, — синдром Миллера-Дикера. Мутация происходит в гене 17-й хромосомы. Главная причина аномалии — интоксикация плода альдегидами, передающимися через материнскую кровь.
На УЗИ синдром Миллера-Дикера выражается в многоводии, отставании внутриутробного развития плода и снижении его двигательной активности. На более поздних сроках можно увидеть утолщение коры головного мозга при разглаживании мозговых извилин.
Голова у больных детей меньше положенного размера, лоб выпуклый, плоский затылок, челюсть недоразвита (алкогольная дизморфия). Ушные раковины расположены ниже положенного уровня, пальцы неправильной формы, тазобедренные суставы находятся на зачаточном уровне, стопы укорочены, задний проход сросшийся.
Такие дети обычно умирают в возрасте в 2 лет из-за аспирационной пневмонии. У них глубокая умственная отсталость и отсутствуют даже обычные рефлексы (глотание, моргание).
2.Причины
Предполагается, что причины возникновения внутриутробных бронхолегочных пороков не отличаются принципиально от тератогенных факторов вообще. В литературе наиболее часто описываются такие экзогенные, внешние тератогенные воздействия, как травма (механическая, температурная, лучевая, химическая), инфекция, курение и употребление алкоголя в период гестации, продолжительный прием некоторых медикаментов. К эндогенным, внутренним причинам относят наследуемые и первичные хромосомные и генные мутации.
Однако установлено, что ключевую патогенетическую роль играет не характер тератогенного фактора, а срок, на котором он «срабатывает»: чем раньше беременная женщина подвергается вредоносному воздействию, тем тяжелее последствия в плане развития бронхолегочной системы плода.
Симптомы
Симптоматика зависит от конкретного типа порока, она весьма вариативна, равно как и сроки возможного выявления таких дефектов. На первые 10 лет жизни ребёнка приходится только 3,8% наблюдаемых пороков лёгких, в возрасте от 10 до 20 лет проявляется 18,2% наблюдаемых пороков, от 20 до 30 – 26,6%, от 30-40 – 37,9%, после 40 – 14%. Пороки развития лёгких могут проходить бессимптомно (21,7% случаев), с признаками нагноения (74,1%), с осложнениями других болезней (4,2%).
На ранних этапах развития ребёнка могут возникнуть такие симптомы дыхательной недостаточности:
- Стеноз основных трахеи и бронхов;
- Трахео и бронхопищеводные свищи;
- Лобарная эмфизема;
- Агенезия;
- Гипоплазия лёгкого;
- Аплазия;
- Стридорозное дыхание;
- Цианоз
- Приступы асфиксии.
Некоторые типы пороков проявляют себя острым воспалительным процессом и возникновением нагноений. Воспалительные процессы, как правило, рецидивирующие, сопровождаются кашлем, большими объёмами гнойной мокроты, эпизодическим отхаркиванием крови, симптомами интоксикации, другими нарушениями самочувствия во время обострений.
ВНУТРИУТРОБНЫЕ ИНФЕКЦИИ
Внутриутробное
инфицирование плода не всегда сопровождается развитием инфекционного
заболевания, что объясняется мобилизацией иммунитета и защитных
механизмов в системе мать-плацента-плод.
Выделяют вирусные заболевания эмбриона и плода и заболевания, вызванные бактериальной флорой.
Для
обозначения инфекций со сходными клиническими проявлениями используют
аббревиатуру TORCH: Т – токсоплазмоз, О – другие (other) инфекции
(сифилис, хламидиоз, энтеровирусные инфекции, гепатиты А и В, гонорея,
листериоз), R – краснуха (rubella), С – цитомегаловирусная инфекция
(cytomegalia), Н – герпесвирусная инфекция (herpes).
Значительное
место среди многообразных возбудителей внутриутробной инфекции занимают
грамотрицательные аэробные бактерии, неспорообразующие анаэробы,
микоплазмы, стрептококки группы В, дрожжеподобные грибы.
Тяжесть
и клинические проявления внутриутробной инфекции зависят от вида
возбудителя, его вирулентности, массивности обсеменения иммунного
статуса организма беременной, срока гестации, а также путей
проникновения возбудителя в организм.
Внутриутробная
инфекция, развившаяся в первые 3 мес гестации, может стать причиной
инфекционных эмбриопатий, врожденных пороков развития плода, первичной
плацентарной недостаточности, неразвивающейся беременности,
самопроизвольного выкидыша. Более неблагоприятны в отношении эмбриопатий
микроорганизмы с внутриклеточным циклом развития (вирусы), обладающие
высоким тропизмом к эмбриональным тканям.
Приобретённые патологии плода
Приобретенные патологии возникают под воздействием негативных факторов (радиация, токсическое отравление) и образа жизни матери (алкоголизм, курение, наркомания).
Врождённые пороки органов и костей
Редко у плода развивается один такой порок, обычно это комплекс патологий, затрагивающих несколько жизненно важных органов.
Врождённые пороки имеют следующие разновидности:
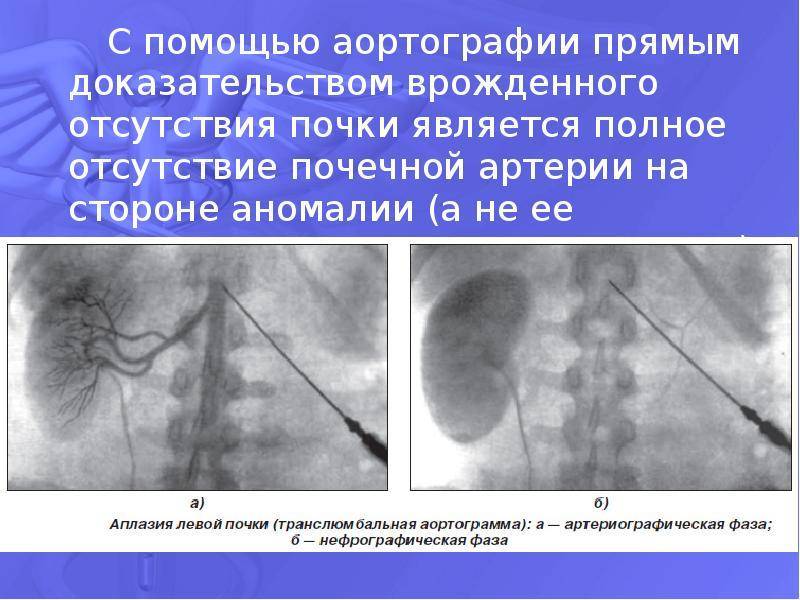
- аплазия — полное отсутствие органа с сохранением сосудистой ножки;
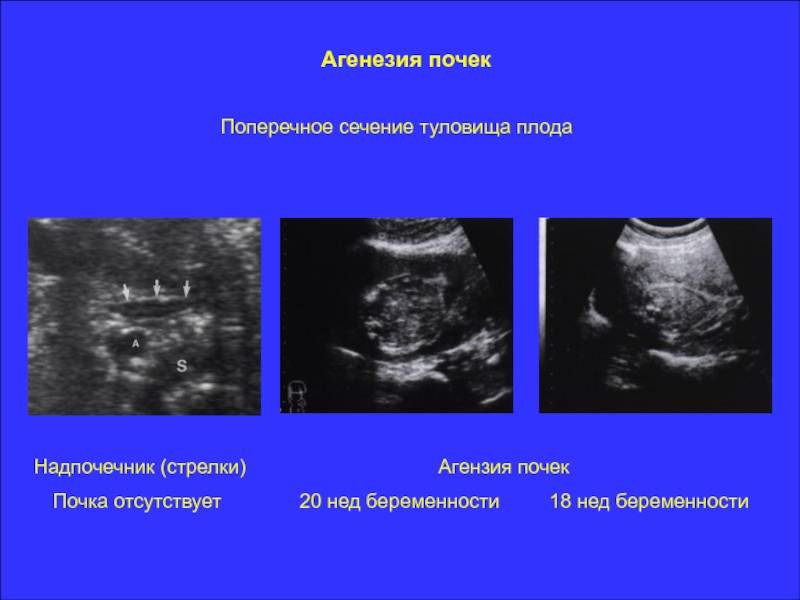
- агенезия — полное отсутствие органа без сохранения сосудистой ножки;
- гипоплазия — недоразвитость органа;
- дистопия — расположение органа в неположенном месте.
Ультразвуковая диагностика врождённых пороков проводится трижды:
- 1-я диагностика — 10-13 недель;
- 2-я диагностика — 19-20 недель;
- 3-я диагностика — 31-32 недели.
Исследование позволяет выявить большинство патологий:
- отсутствие или деформацию органа;
- анэнцефалию (отсутствие головного мозга);
- атрезию (отсутствие) конечностей;
- аномалия скелета лица (заячья губа, волчья пасть);
- незаращение спинномозгового канала;
- пороки сердца;
- гидроцефалия (скопление жидкости в головном мозге).
Гипертензионно-гидроцефальный синдром
Это патология, при которой спинномозговая жидкость скапливается под мозговыми оболочками. Осложнение выявляется на УЗИ на поздних этапах беременности.
Характеризуется большим объёмом головы плода, диспропорцией между мозговыми долями, выпиранием родничка. Чем раньше выявлена патология, тем больше шансов на благоприятный исход.
Гидроцефалия
Это скопление спинномозговой жидкости в желудочках головного мозга, в результате чего они увеличиваются в размерах, и возрастает внутричерепное давление.
Гидроцефалию выявляют на 2 семестре беременности. Главным показателем является увеличение высоты тела желудочка головного мозга выше нормы (свыше 1,1 см). При этом снижается эхогенность межполушарной щели при одновременном увеличении ширины щели свыше 5 мм.
Пороки сердца
Пороки сердца у плода — не редкость. На УЗИ они обнаруживаются на 2-м плановом осмотре (скрининговом УЗИ второго триместра).
К ним относятся:
- гипоплазия левой стороны сердца;
- отсутствие сообщения между правыми камерами сердца;
- отсутствие одного из желудочков сердца;
- патология сердечной мышцы;
- аритмия;
- брадикардия;
- сужение просвета аорты;
- сужение лёгочной артерии;
- порок трикуспидального клапана;
- тетрада Фалло (сочетанная аномалия сердца).
Большая часть сердечных патологий исправляется хирургическим путём. Чем раньше проведена операция, тем больше шансов на успешное выздоровление.
Врождённые патологии плода — трисомии
Такие патологии встречаются часто, но большинство эмбрионов с хромосомными аномалиями гибнут внутриутробно в результате спонтанных выкидышей. Трисомии имеют генетическую природу и возникают в момент зачатия.
Чтобы предупредить рождение малышей с тяжелыми патологиями, семейным парам, планирующим рождение ребёнка, рекомендуют пройти кариотипирование — изучение хромосомных наборов, позволяющее определить генетическую совместимость и возможность иметь здоровое потомство.
Кариотипирование имеет 99% достоверность, благодаря которой можно заранее узнать, имеют ли супруги предрасположенность к хромосомным мутациям.
На ранних сроках без специальных анализов обнаружить трисомию невозможно. С этой целью проводится перинатальный скрининг — серия анализов, определяющих врождённые аномалии плода. Первый скрининг проводится на сроке 11-13 недель и включает ультразвуковую диагностику и анализы крови на гормоны.
Скрининг проводится добровольно. Но процедуру настоятельно рекомендуется пройти женщинам из группы риска, которые:
- забеременели в возрасте старше 35 лет;
- имели замершие беременности;
- подвергались ионизированному или радиационному облучению;
- работают на предприятиях химической промышленности;
- имеют вредные привычки (курение, употребление алкоголя и наркотиков);
- неблагоприятная экологическая обстановка;
- возраст отца ребенка старше 50 лет.
УЗИ определяет:
- положение эмбриона в матке (исключение внематочной беременности);
- количество плодов (одноплодная или многоплодная беременность);
- форма конечностей, черепа, строение лица;
- сердцебиение;
- устанавливается копчико-теменной размер (высота плода от копчика до темечка);
- нормальное или патологическое строение головного мозга;
- толщина воротникового пространства:
- размер носовой кости:
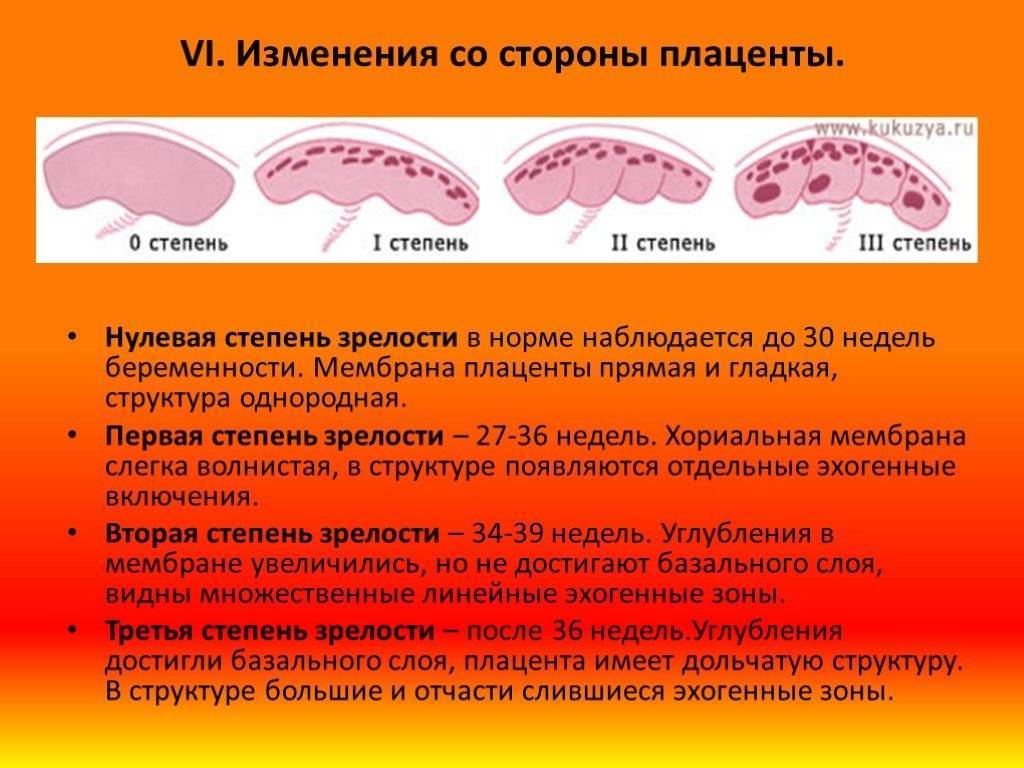
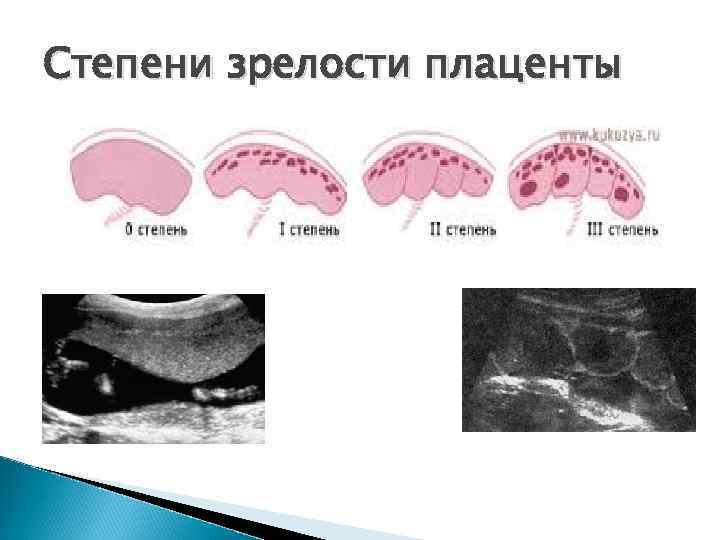
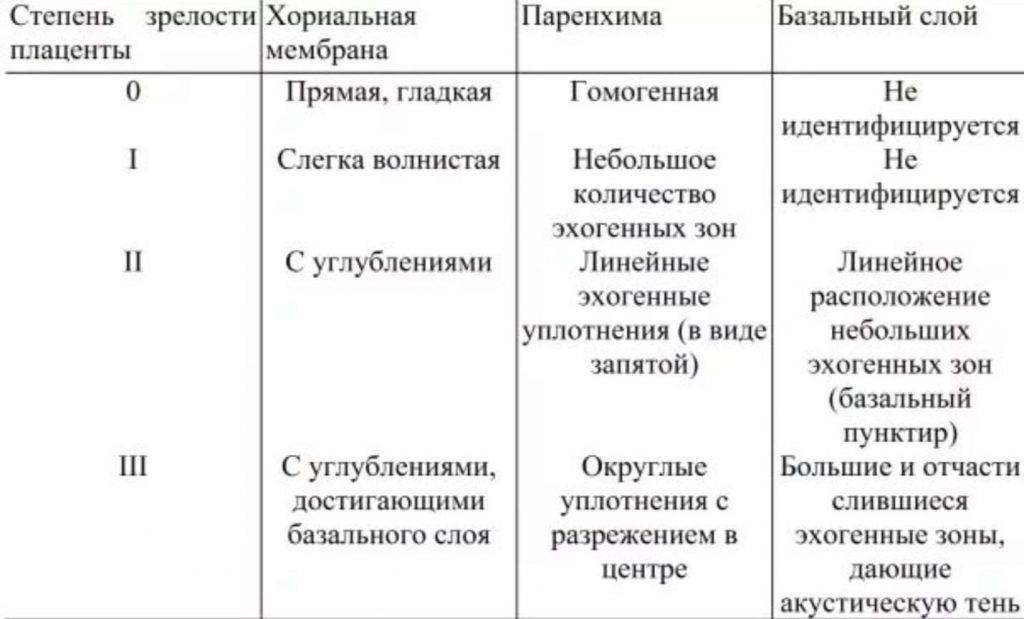
- зрелость и функциональность плаценты.
ИЗОСЕРОЛОГИЧЕСКАЯ НЕСОВМЕСТИМОСТЬ КРОВИ МАТЕРИ И ПЛОДА. ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ ПЛОДА И НОВОРОЖДЕННОГО
Причиной
изосерологической несовместимости крови матери и плода является
различие антигенных факторов эритроцитов по системе резус: кровь матери
резус-отрицательная, плода – резус-положительная. Выявление у женщин с
резус-отрицательной кровью антирезус-антител указывает на сенсибилизацию
к резус-фактору, вследствие которой возможно развитие гемолитической
болезни плода и новорожденного (синоним – эритробластоз).
Резус-фактор
– система аллогенных эритроцитарных антигенов человека, дифференциация
которого начинается в ранние сроки внутриутробного развития (с 6-8 нед
гестации).
Белковый фактор в эритроцитах, обладающий
антигенными свойствами, был впервые обнаружен американскими учеными К.
Ландштейнером и А. Винером в 1940 г. В эксперименте они показали, что
эритроциты обезьян (макака-резус), введенные кроликам, вызывали у
кроликов выработку антител.
В настоящее время
выделяют 6 основных резус-антигенов Rh (Dd, Cc, Ee). Каждый генный
комплекс состоит из трех антигенных детерминант: D или отсутствие D, С
или с, Е или е в различных комбинациях. Существование антигена d не
подтверждено, так как не известен ген, отвечающий за синтез этого
антигена. Несмотря на это, символ d применяется в иммуногематологии для
обозначения отсутствия антигена D на эритроцитах при описании фенотипов.
Другими изосерологическими системами крови, с
которыми может быть связан иммунный конфликт, являются системы
Келл-Челлано, Даффи, Кидд, MNSs, Лютеран.
ДЫХАТЕЛЬНЫЕ РАССТРОЙСТВА У НОВОРОЖДЕННЫХ
Синдром дыхательных расстройств новорожденного проявляется в первую очередь дыхательной недостаточностью.
Наиболее
часто синдром дыхательных расстройств наблюдается у недоношенных детей,
что связано с незрелостью системы сурфактанта (созревание системы
сурфактанта завершается к 35-36 нед) и его дефицитом к моменту рождения.
Недостаток сурфактанта – поверхностно активного вещества,
синтезируемого альвеолоцитами 2-го типа, – приводит к спадению альвеол
на выдохе и в результате, к снижению площади газообмена в легких,
гипо-ксемии и гиперкапнии. Незрелость системы сурфактанта приводит к
развитию гиалиновых мембран, отечно-геморрагического синдрома и др.
Гипоксия
плода как патогенетический фактор синдрома дыхательных расстройств
имеет не меньшее значение, чем гестационный возраст к моменту рождения.
Гипоксия может приводить к вазоконстрикции и гипоперфузии легких,
инактивации альвеолярного сурфактанта.
Одной из причин
синдрома дыхательных расстройств является аспирация околоплодных вод,
мекония и крови, которые вызывают обструкцию дыхательных путей и
повреждают сурфактантную систему легких, в результате чего у
новорожденных развивается дыхательная недостаточность.
Развитию
синдрома дыхательных расстройств способствуют задержка резорбции
фетальной жидкости из дыхательных путей новорожденных, персистирующие
фетальные коммуникации, а также пневмония.
Острое
развитие дыхательной недостаточности в первые часы и дни после рождения
может быть обусловлено пороками развития верхних дыхательных путей и
легких (атрезия хоан, пищеводно-трахеальные свищи, долевая эмфизема,
агенезия и гипоплазия легких, поликистоз, диафрагмальная грыжа).
ГИПОКСИЯ ПЛОДА И АСФИКСИЯ НОВОРОЖДЕННОГО
Термин
“гипоксия плода” предложен ВОЗ для обозначения кислородной
недостаточности. В некоторых странах используют также термины “дистресс
плода” и “асфиксия плода”.
Под асфиксией в
общеклинической практике подразумевают удушье, т.е. недостаток кислорода
и накопление углекислого газа в организме (гиперкапния), нередко
приводящие к остановке сердца. Термин “асфиксия” применительно к
состоянию плода и новорожденного является условным, так как кислородная
недостаточность в этих случаях не всегда сопровождается выраженными
нарушениями сердечной деятельности и гиперкапнией.
В
нашей стране при кислородной недостаточности во внутриутробном периоде
используют термин “гипоксия плода”. Для характеристики состояния
новорожденных, родившихся с явлениями кислородной недостаточности,
применяют термин “асфиксия”.
В различные периоды
беременности и родов кислородная недостаточность обусловливает
неодинаковые последствия для эмбриона, плода и новорожденного. В период
органогенеза выраженная гипоксия может сопровождаться нарушением
развития эмбриона вплоть до его гибели. Кислородное голодание в период
фетогенеза может приводить к задержке роста плода, поражению его ЦНС.
Кислородная недостаточность в зависимости от ее степени приводит к
асфиксии, нарушению адаптации новорожденного в постнатальном периоде,
мертворождению и смерти новорожденных в раннем неонатальном периоде.
Гипоксия плода –
недостаточное снабжение кислородом тканей и органов плода или
неадекватная утилизация кислорода. Гипоксию плода различают по
длительности, интенсивности и механизму развития.
В зависимости от длительности выделяют хроническую и острую гипоксию плода.
Обсуждение
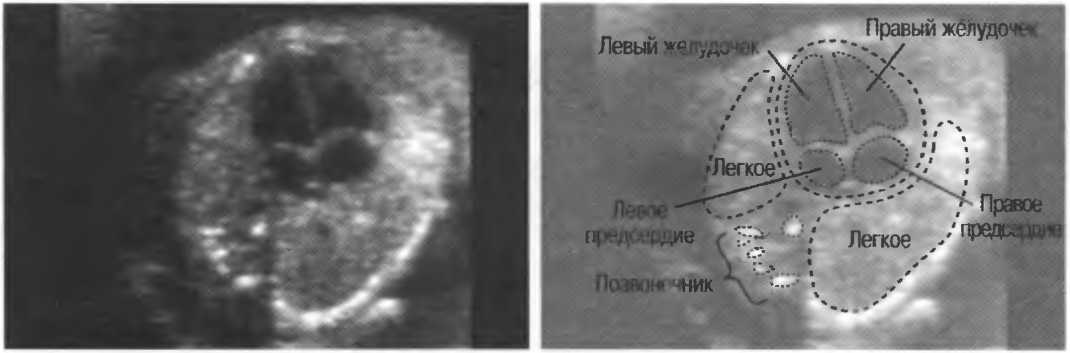
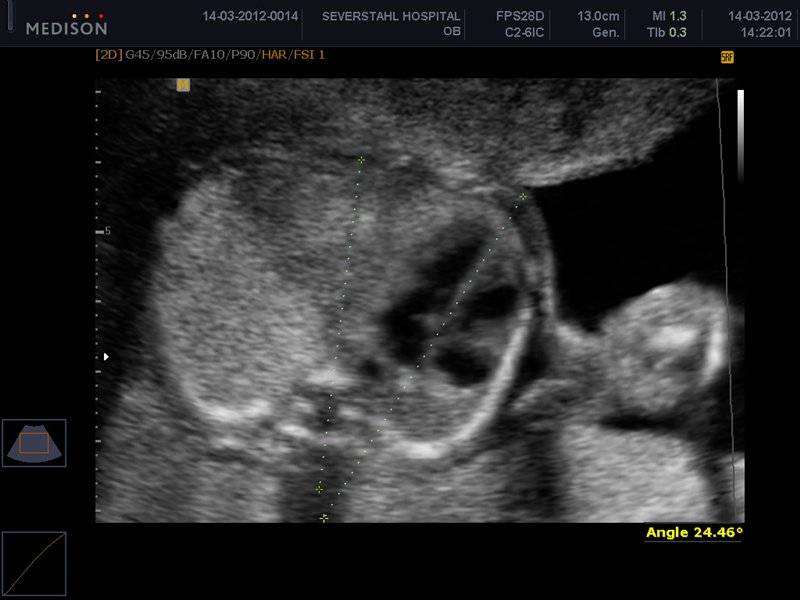
На сегодняшний день нет единого сонографического стандарта исследования легких плода. В нашем исследовании мы использовали 3-D индексы для определения маркеров зрелости легких плода у женщин с нормальной беременностью и сравнили уровень фосфоглицеридов в амниотической жидкости. Мы обнаружили, что FLLIR > 1.1, FLV > 50 мл и регулярные дыхательные движения после 34 недель беременности коррелирует со зрелостью легких плода.
Поскольку легкие и печень плода находятся в одинаковых средах и эхогенность печени является относительно стабильной, FLLIR может служить полезным показателем зрелости легких. Для того чтобы свести к минимуму ошибки в эксперименте, мы рассматривали эхограммы легких и печени плода на той же глубине три раза, и определили средние данные в качестве конечного результата.
- Просмотры:
- Комментарии:
Понравилась запись? Считаете ее полезной или интересной? Поддержите автора!