Фенотипы бронхиальной астмы
Возраст и характерные триггеры могут использоваться для выделения фенотипов бронхиальной астмы. Выделение отдельных фенотипов может быть целесообразным, поскольку бронхиальная астма у детей является гетерогенной. Будучи частью “синдрома астмы”, фенотипы бронхиальной астмы не являются отдельными заболеваниями. Рекомендации, учитывающие различные фенотипы бронхиальной астмы, должны помочь оптимизировать тактику лечения и прогноз. Ниже приведены критерии, использующиеся для определения фенотипов бронхиальной астмы.
Возраст и бронхиальная астма
Возраст – один из наиболее значимых критериев, определяющих фенотип бронхиальной астмы у детей. Клиническая картина бронхиальной астмы в разных возрастных группах отличается рядом особенностей, и поэтому выбор методов диагностики и стратегии лечения должен быть основан на возрасте. На практике для этих целей выделяют следующие возрастные группы:
- младенцы (от 0 до 2 лет);
- дошкольники (от 3 до 5 лет);
- школьники (от 6 до 12 лет);
- подростки.
Младенцы. У детей раннего возраста персистирование симптомов является основным критерием тяжести заболевания. Поэтому следует установить, действительно ли у ребенка симптомы обструкции отмечались в большинство дней недели на протяжении последних 3 месяцев. Если это так, то после тщательного исключения иных причин у ребенка диагностируют персистирующую младенческую обструкцию. У детей с интермиттирующими симптомами (рецидивирующими эпизодами) диагностируют тяжелую или легкую форму заболевания в зависимости от того, нуждаются ли они в приеме системных глюкокортикостероидов (ГКС), госпитализациях и т.д.
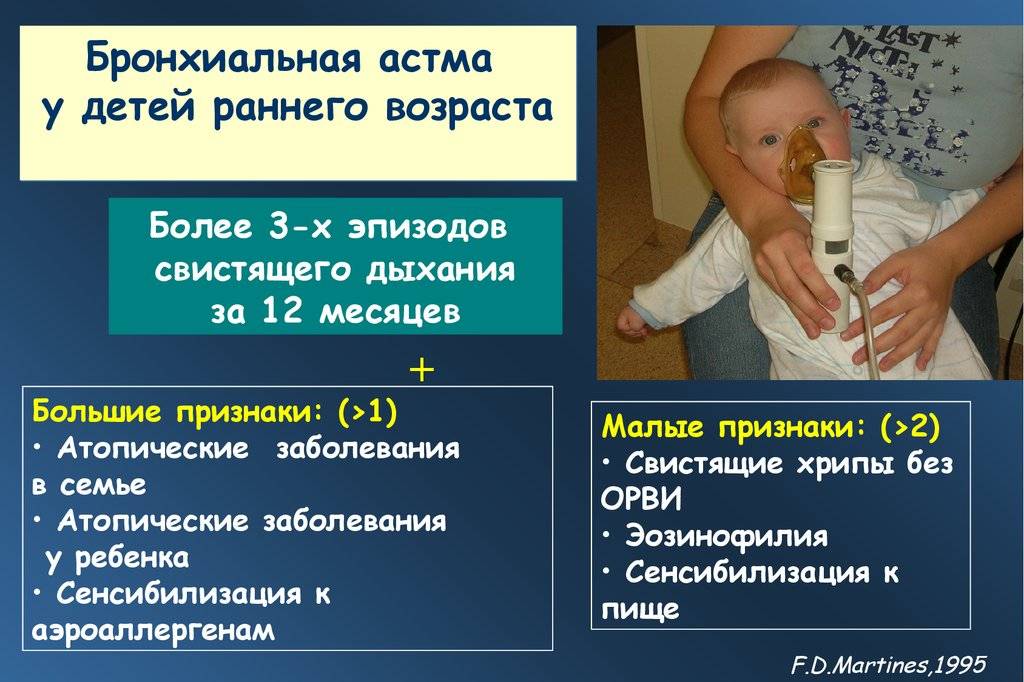
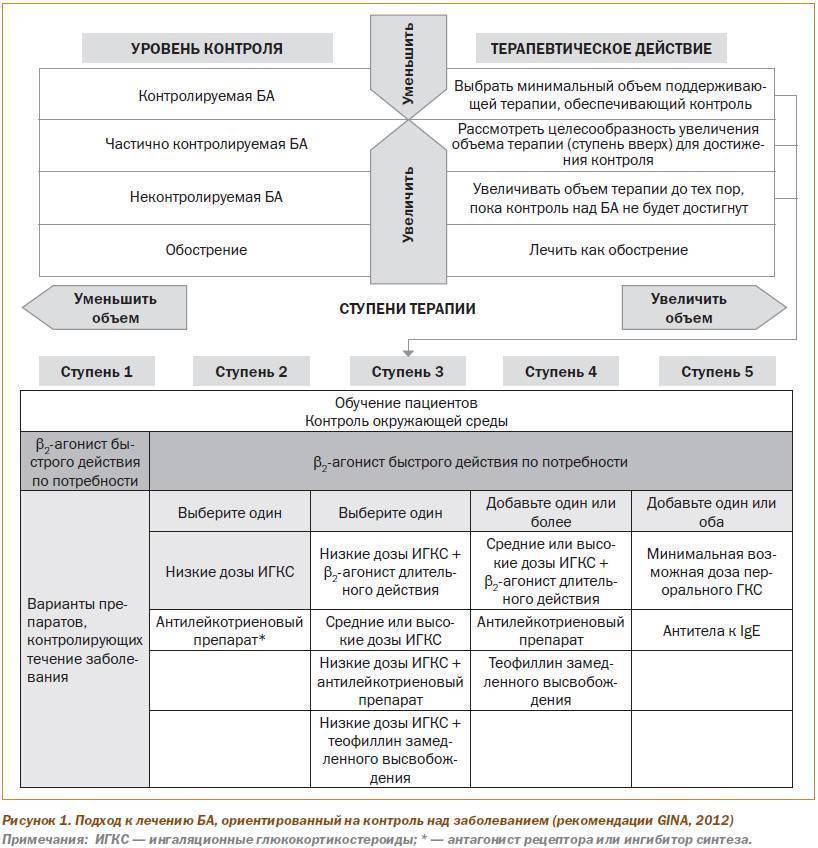
Дошкольники. У детей дошкольного возраста ключевым критерием для дифференциальной диагностики фенотипа бронхиальной астмы является персистирование симптомов на протяжении последнего года (рис. 1).
Если в период между приступами нет никаких симптомов, а симптомы в большинстве случаев возникают после простуды, наиболее вероятна вирусиндуцированная бронхиальная астма. В этой возрастной группе вирусы являются наиболее частыми триггерами. В этой возрастной группе может встречаться в виде отдельного фенотипа и бронхиальная астма, связанная с физической нагрузкой.
Необходимо провести кожные аллергопробы или определение уровней специфических IgE, а также уточнить, есть ли клинически значимая связь между контактом с аллергеном и появлением симптомов. Положительные результаты обследования свидетельствуют о наличии фенотипа аллергениндуцированной бронхиальной астмой. Следует подчеркнуть, что атопия является фактором риска для персистирования бронхиальной астмы независимо от того, доказана ли роль аллергенов как триггеров заболевания
Если не удается установить аллергены, которые играют роль триггера, с определенной осторожностью такой фенотип следует охарактеризовать как неаллергическую бронхиальную астму. Тем не менее это может означать, что причинный аллерген пока не был обнаружен.
Школьники
Критерии дифференциации фенотипов у детей школьного возраста такие же, как и у дошкольников (см. рис. 1). Однако аллергениндуцированная бронхиальная астма выявляется чаще и становится более явной (в том числе сезонность обострений). Вирусиндуцированная бронхиальная астма также остается распространенной формой заболевания у пациентов этой возрастной группы. Тяжесть течения заболевания может становиться серьезной проблемой при лечении аллергениндуцированной бронхиальной астмы.
Подростки. Атопическая бронхиальная астма может впервые проявляться в подростковом возрасте, причем новых случаев бронхиальной астмы появляется больше, чем развивается ремиссий. У подростков может впервые развиться и неатопическая бронхиальная астма. В этой возрастной группе могут возникать дополнительные проблемы при выборе тактики ведения. Многие подростки сопротивляются регулярному приему лекарств и любым ограничениям в образе жизни; нередко подростки курят. Кроме того, могут возникать проблемы во время перехода подростка от наблюдения педиатром к другому специалисту.
Лечение бронхиальной астмы, индуцированной физической нагрузкой
Постнагрузочный бронхоспазм у детей является частым клиническим проявлением бронхиальной астмы, наблюдаясь у 70–80% детей с бронхиальной астмой, которые не получают противовоспалительной терапии. Постнагрузочный бронхоспазм в отсутствие других проявлений бронхиальной астмы можно контролировать β2-агонистами КД за 10–15 мин перед нагрузкой. Если у пациента есть и другие проявления бронхиальной астмы, то заболевание лучше контролируется монотерапией ИГКС или их комбинацией с бронхолитиками. Согласно современным данным, АЛР могут служить альтернативой ИГКС при этом варианте заболевания, поскольку они способны быстро и длительно предотвращать падение ОФВ1 при нагрузке. Регулярное использование АЛР не вызывает толерантности к их бронхопротективному эффекту.
Если полный контроль не достигается с помощью ИГКС, то к лечению ИГКС можно добавить ингаляционные β2-агонисты КД перед нагрузкой, АЛР или ингаляционные β2-агонисты ДД. К ингаляционным β2-агонистам при регулярном использовании возможно развитие толерантности. У некоторых пациентов для предотвращения постнагрузочного бронхоспазма может быть необходима комбинация ИГКС, АЛР и β2-агонистов ДД. Можно попытаться использовать ипратропия бромид (обычно в дополнение к другим препаратам). Недостаточный эффект терапии при постнагрузочном бронхоспазме может быть связан с ошибочным диагнозом.
Резистентная к терапии бронхиальная астма
Резистентная к терапии (“трудная”) бронхиальная астма, на наличие которой указывает частое использование β2-агонистов КД, несмотря на высокие дозы ИГКС, может протекать атипично. Во всех случаях необходимо исключить другие возможные причины астмаподобных симптомов и негативное влияние факторов окружающей среды.
Выбор ингаляционного устройства
Предпочтительный метод назначения ИГКС и β2-агонистов – дозированные аэрозольные ингаляторы со спейсером или порошковые ингаляторы. Однако в ряде случаев может быть предпочтительным компрессорный небулайзер (в связи с недостаточным ответом на терапию, тяжестью состояния, персональными предпочтениями или удобством), особенно у детей младше 4–5 лет, которые не могут пользоваться названными устройствами. Для длительной терапии необходим выбор устройства в зависимости от возраста, чтобы обеспечить высокий комплайнс и таким образом – наилучшую клиническую эффективность и отношение стоимость/эффект.
Иммунотерапия бронхиальной астмы
Специфическая иммунотерапия (СИТ) может предотвратить сенсибилизацию к другим аллергенам, предотвращает прогрессирование аллергического ринита в бронхиальную астму и уменьшает риск развития бронхиальной астмы у детей с сезонной аллергией. Эффект СИТ после ее прекращения сохраняется, обеспечивая длительную клиническую ремиссию, особенно аллергического ринита. Эффективность СИТ зависит от качества используемых экстрактов аллергенов.
Подтвержден выраженный и длительный эффект подкожной и сублингвальной СИТ, хотя последний метод у детей младше 5 лет изучен недостаточно. На основании систематического обзора заключают, что сублингвальная СИТ оказывает только слабый или умеренный эффект у детей старше 4 лет с легкой/среднетяжелой бронхиальной астмой, сенсибилизированных только к клещам домашней пыли. Эффективность методов сходна, однако сублингвальная СИТ более привлекательна для детей и родителей.
Бронхиальная астма без аллергической сенсибилизации не является показанием для СИТ. Сенсибилизация более чем к одному аллергену не является противопоказанием для СИТ, но может уменьшить ее эффективность. Возраст также не служит абсолютным противопоказанием, такая терапия может использоваться с 3 лет.
Лечение Бронхиальной астмы у детей:
1. Уменьшить или полностью прекратить контакт ребенка с аллергеном, являющимся причиной заболевания.
2. Провести фаркакотерапию (для больных атопической бронхиальной астмой).
3. Провести специфическую иммунотерапию.
Специфическую иммунотерапию проводят, если невозможно прекратить контакт ребенка с аллергеном, четко подтвердить аллерген, есть больному от 5 лет. Специфическую иммунотерапию нельзя проводить, если:
- болезнь на стадии обострения
- есть выраженные осложнения
- у ребенка есть опухоли
- легочное сердце с явлениями хронической недостаточности функции внешнего дыхания и кровообращения
- у ребенка аутоиммунные заболевания
- при хронических обострившихся инфекциях
- при психических обострившихся заболеваниях
- если у ребенка тяжелые болезни нервной и эндокринной системы, внутренних органов
- при заболеваниях крови
- если у малыша обнаружены острые инфекционные заболевания.
Общие рекомендации по лечению бронхиальной астмы у детей:
1. Создать комфортные спокойные условия ребенку.
2. Исключить или минимизировать контакт с аллергенами.
3. Исключить эмоциональное и физическое напряжение
4. Не давать ребенку медикаменты, на которые у него непереносимость.
5. Исключить из жизни ребенка факторы, что провоцируют удушье, к пример, косметические средства или дым.
5. Обеспечить гипоаллергенный рацион.
Лекарства от бронхиальной астмы
Острые приступы бронхиальной астмы у детей купируют при помощи таких медикаментов (в дозированных ингаляторах или энтерально) :
– глюкокортикостероиды системного действия
– мимпатомиметики, Р2-агонисты короткого действия
– холинолитики
– метилксантины короткого действия
Приступов бронхоспазма можно избежать при помощи профилактических мер: принимают препараты кромоглициевой кислоты, глюкокортикостероиды, антигистаминные препараты со стабилизирующим действием на мембраны тучных клеток и пр.
Тяжелое течение
Длительными курсами принимают глюкокортикостероиды по назначению врача. Препараты для противовоспалительной терапии: преднизолон, гидрокортизон, метилпреднизолон, дексаметазон, триамцинолон, бетаметазон.
Делают ингаляции такими препаратами:
- будесонид
- беклометазон дипропионат
- флутиказон пропионат
- флунизолид гемигидрат
Показан прием бронхолитических препаратов:
– аминофиллин
– препараты теофиллина пролонгированного действия
– сальбутамол
– сальметерол
– фенотерола гидробромид
– формотерола фумарат
– ипратропиум бромид
– беродуал
Среднетяжелое течение
Делают ингаляции такими препаратами:
– беклометазона дипропионат (распределяют суточную дозу на 4 приема, прыскают через равные интервалы времени; применяют бекломет, бекотид, альдецин)
– будесонид (распределяют суточную дозу на 2 приема, прыскают через равные интервалы времени; применяют бенакорт, будесонид пульмикорт)
– флунизолида гемигидрат (суточную дозу делят на 2 приема)
– флутиказона пропионат (аналогично – суточная доза делится на два приема)
Проводят длительные курсы препаратов кромоглициевой кислоты: кромогликата натрия, недокромила натрия.
Лечение проводят антигистаминными препаратами со стабилизирующим действием на тучные клетки, к примеру, кетотифеном. Применяются также антагонисты лейкотриеновых рецепторов: монтелукаст, зафирлукаст.
Ребенку при среднетяжелом течении бронхиальной астмы прописывают бронхолитические препараты:
1. аминофиллин
2. препараты теофиллина пролонгированного действия (среди них: неотеопек, теопек, вен-такс, ретафил, эуфилонг)
3. сальбутамол
4. фенотерола гидробромид
5. сальметерол
6. формотерола фумарат
7. ипратропиум бромид (суточная доза 20-40-80 мкг делится на два-три раза)
8. беродуал
Легкое персистирующее течение
Умуренными дозами делают ингаляции глюкокортикостероидов, к примеру, будесонида, беклометазона дипропионата и пр.
Проводят лечение препаратами кромоглициевой кислоты:
– кромогликат натрия
– недокромил натрия
По назначению врача принимают:
- препараты, оказывающие стабилизирующее действие на тучные клетки, к примеру, кетотифен
- антагонисты лейкотриеновых рецепторов (монтелукаст, зафирлукаст)
- бронхолитические лекарства для купирования острых симптомов заболевания
Также детям показано немедикаментозное лечение: ЛФК, физиотерапия, массаж (после купирования обострений бронхиальной астмы).
При легком течении лечение в стационаре длится от 7 до 14 суток, при среднетяжелом течении лечение длится от 14 до 20 дней, а при тяжелом – 20-28 суток..
Диагностика бронхиальной астмы
Не существует патогномоничных симптомов или суррогатных маркеров, по которым можно было бы диагностировать бронхиальную астму у детей в первые годы жизни. В связи с этим диагноз бронхиальной астмы следует заподозрить у любого ребенка с рецидивирующими обструкцией и приступами кашля. Нередко диагноз можно установить только в процессе длительного наблюдения, в результате проведения тщательной дифференциальной диагностики и оценки реакции ребенка на бронхолитики и/или противовоспалительное лечение.
Анамнез в диагностике бронхиальной астмы
В истории болезни следует обратить внимание на частоту и тяжесть таких симптомов, как свистящее дыхание, кашель по ночам, возникновение жалоб при физической нагрузке, а также на персистирование кашля после простудных заболеваний, атопическую наследственность, контакт с аллергенами и табачным дымом. Следует выяснить динамику симптомов за последние 3–4 мес, обратив особое внимание на те, которые беспокоили в течение предшествующих 2 нед
Свистящее дыхание должно быть подтверждено врачом, поскольку родители могут неправильно интерпретировать звуки, издаваемые ребенком при дыхании.
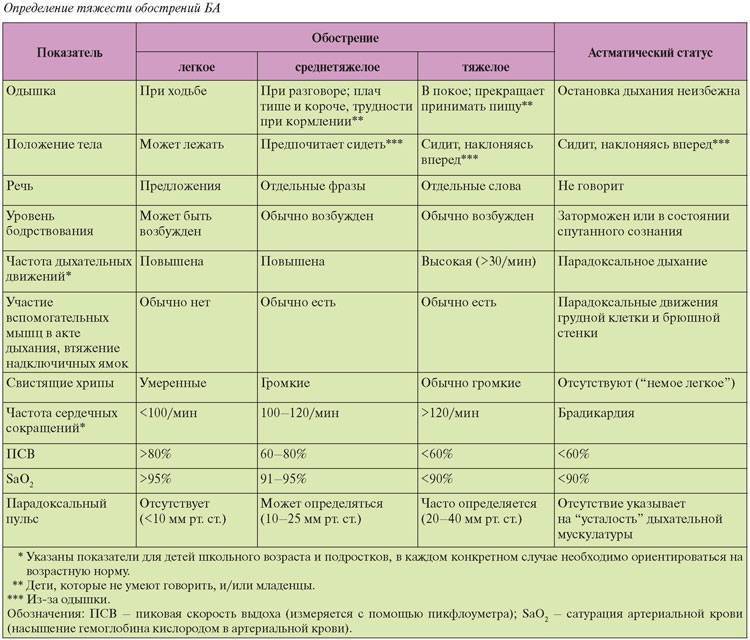
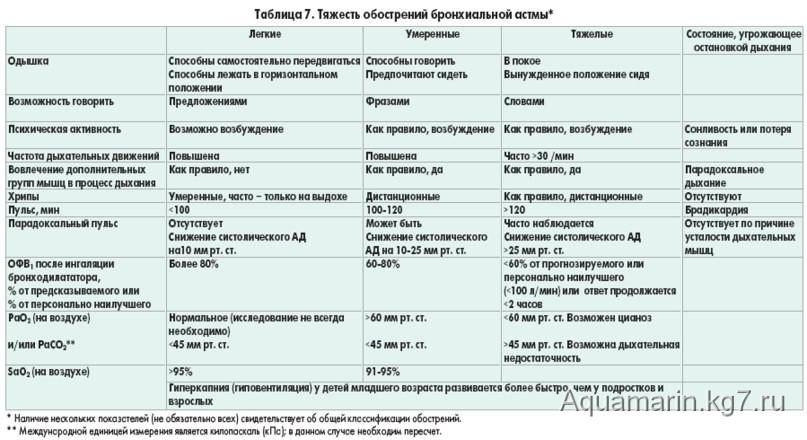
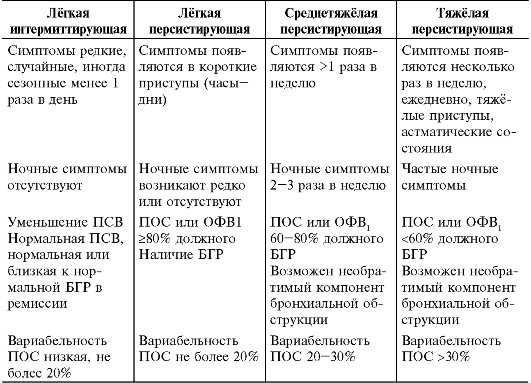
Тяжесть бронхиальной астмы
Тяжелая бронхиальная астма и у детей, и у взрослых отличается рядом особенностей, заслуживая выделения в особый фенотип. Тяжесть бронхиальной астмы ассоциируется с персистированием и резистентностью к лечению. Хотя тяжесть используется как дополнительный критерий при определении фенотипа, степень тяжести зачастую определяется произвольно. Оценка тяжести бронхиальной астмы зависит от возраста. У детей раннего возраста при персистировании заболевания его следует расценивать как тяжелое. У детей старшего возраста тяжелыми следует считать обострения, при которых возникает необходимость в оксигенотерапии и госпитализации. Они могут развиваться независимо от обычных признаков тяжелого течения, т.е. частоты симптомов или функции дыхания.
Дифференциальный диагноз бронхиальной астмы и сопутствующие заболевания
У детей с тяжелыми рецидивирующими приступами свистящего дыхания и у грудных детей с персистирующим свистящим дыханием, не поддающимся лечению, следует исключать другие заболевания и отягощающие факторы. Среди них гастроэзофагеальный рефлюкс, ринит, аспирация инородного тела, муковисцидоз, пороки развития верхних или нижних дыхательных путей. В таких случаях может потребоваться выполнение фибробронхоскопии с бронхоальвеолярным лаважом, компьютерной томографии грудной клетки или определение рН в пищеводе. Кроме того, следует оценивать ответ на лечение. Если лечение ИГКС, антагонистами лейкотриеновых рецепторов (АЛР) или бронхолитиками эффекта не дает, следует повторно верифицировать диагноз бронхиальной астмы.
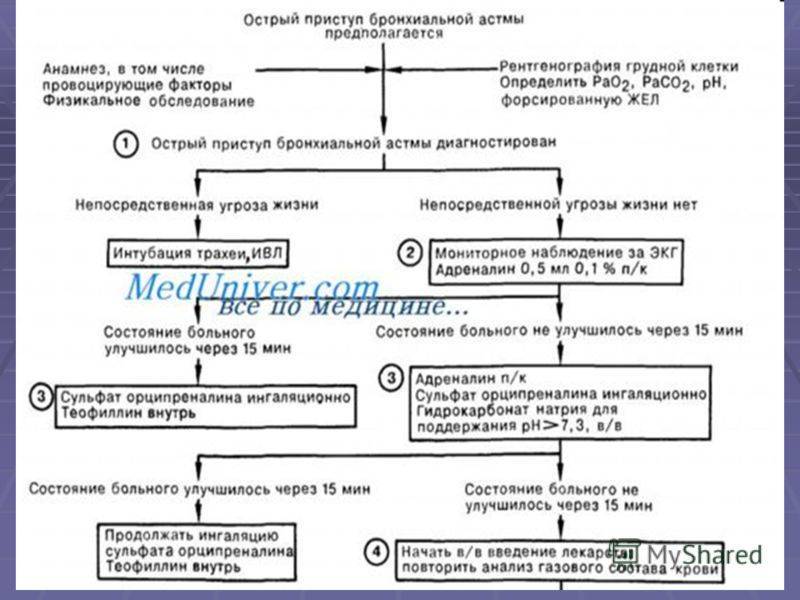
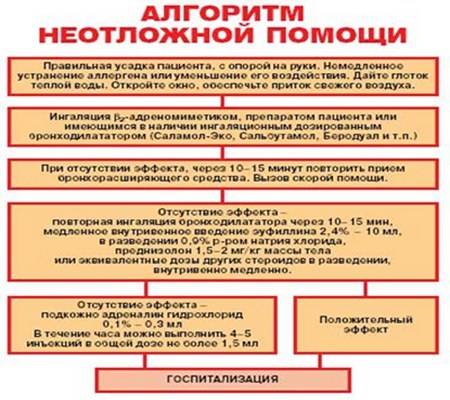
Лечение обострений бронхиальной астмы
Ступенчатое лечение обострения бронхиальной астмы проводят следующим образом (вмешательства применяются в зависимости от их доступности и места, где проводится терапия, – дома, у врача общей практики или в стационаре):
ингаляции β2-агонистов КД через спейсер по 2–4 вдоха сальбутамола каждые 10–20 мин в течение 1 ч, при отсутствии улучшения показана госпитализация;
β2-агонисты через небулайзер – 2,5–5 мг сальбутамола можно повторять каждые 20–30 мин;
ипратропия бромид смешивают с раствором β2-агониста в дозе 250 мкг и ингалируют через небулайзер каждые 20–30 мин;
кислородотерапия для обеспечения нормальной оксигенации;
пероральные и внутривенные ГКС имеют сходную эффективность, пероральные ГКС предпочтительнее ингаляционных ГКС. Доза преднизолона – 1–2 мг/кг (более высокие дозы могут быть использованы в стационаре), обычно достаточно до 3 дней лечения;
β2-агонисты внутривенно: раннее добавление болюсных доз сальбутамола внутривенно (15 мкг/кг) может быть полезным, затем проводится продолжительная инфузия в дозе 0,2 мкг/кг/мин;
ребенок должен быть переведен в отделение интенсивной терапии, если наблюдается прогрессивное ухудшение состояния и не поддерживается достаточная оксигенация. Маленькие дети с ограничением вентиляционных резервов имеют наибольший риск развития дыхательной недостаточности;
аминофиллин используется в условиях отделения интенсивной терапии при тяжелом и жизнеугрожающем бронхоспазме, не отвечающем на максимальные дозы бронхолитиков и системных ГКС. Вначале его вводят в дозе 6 мг/кг в течение 20 мин, мониторируя ЭКГ, затем продолжают длительную внутривенную инфузию
Необходима особая осторожность при наличии факторов, влияющих на метаболизм аминофиллина.
Бронхиальная астма. Общие сведения
Бронхиальная астма относится к наиболее частым хроническим заболеваниям детского возраста во всех развитых странах. Частота бронхиальной астмы наиболее высока у детей с семейной предрасположенностью к атопии. Симптомы и обострения бронхиальной астмы провоцируются многочисленными триггерами, включая вирусные инфекции, аллергены, физическую нагрузку, табачный дым и другие поллютанты.
У детей рецидивирующие симптомы бронхиальной обструкции (прежде всего свистящее дыхание и кашель) нередко возникают уже в первые месяцы жизни, как правило, на фоне инфекций нижних дыхательных путей, но клинический диагноз бронхиальной астмы достоверно может быть установлен обычно лишь после 5 лет, поэтому ранняя диагностика, мониторинг и лечение бронхиальной астмы приобретают особое значение.
К моменту подготовки Консенсуса PRACTALL существовало несколько национальных руководств, но отсутствовали современные международные рекомендации, которые бы фокусировались на бронхиальной астме у детей, хотя частота этого заболевания у детей выше, чем у взрослых. Вопросы фармакотерапии бронхиальной астмы у детей представлены в недавно обновленном варианте GINA. Вместе с тем в этом документе представлена лишь ограниченная информация, касающаяся особенностей БА у детей (прежде всего в возрасте до 5 лет), которая не учитывает опыт детских аллергологов и пульмонологов. В отличие от взрослых пациентов выбор тактики лечения у детей до 5 лет весьма ограничен. Проблему усложняют также отсутствие данных рандомизированных контролируемых исследований у детей и трудности в применении представленных в систематических обзорах критериев для установления диагноза.
Консенсус PRACTALL основан на данных доступной литературы (до июня 2007 г.) и учитывает последние достижения современной клинической практики. В документе представлен обзор естественного течения и патофизиологии бронхиальной астмы у детей и содержатся рекомендации по диагностике, тактике лечения и мониторингу бронхиальной астмы. Он предназначен как для педиатров, так и для врачей общей практики стационаров и поликлиник.
Обучение детей с бронхиальной астмой
Образование является обязательным компонентом в программе лечения, и оно должно начинаться как можно раньше. Образование должно повышать знания о бронхиальной астме, уменьшать боязнь медикаментов и улучшать коммуникабельность между детьми. Следует объяснять необходимость в длительном ежедневном использовании лекарств у детей со среднетяжелой и тяжелой бронхиальной астмой. Уровень обучения должен основываться на возрасте ребенка и тяжести заболевания.
Мониторирование контроля за течением бронхиальной астмы
Для мониторирования степени контроля бронхиальной астмы используются обычные клинические методы: анамнез, физикальное обследование, функциональные тесты.
Бронхиальная астма является хорошо контролируемой (согласно GINA 2006), когда достигнуто и поддерживается следующее:
- дневные симптомы не чаще 2 раз в неделю (и не более 1 раза в день);
- нет ограничений активности из-за симптомов бронхиальной астмы;
- ночные симптомы не чаще 1 раза в месяц (2 раз в месяц, если ребенок старше 12 лет);
- использование препаратов неотложной терапии не чаще 2 раз в неделю;
- нормальная функция легких (если есть возможность измерить);
- не более 1 обострения за прошедший год.
В отличие от взрослых дети (особенно дошкольники) могут переносить 1–2 обострения в год, и бронхиальная астма может считаться контролируемой, если симптомы отсутствуют вне обострений.
Факторы, сочетающиеся с плохим контролем бронхиальной астмы, включают контакт ребенка с табачным дымом и недооценку родителями психосоциальных аспектов бронхиальной астмы.
Спирометрия должна быть проведена при каждом посещении пациентом врача. Наиболее информативными функциональными параметрами являются пиковая скорость выдоха и ОФВ1, причем ОФВ1 также служит предиктором обострений бронхиальной астмы у детей. Отношение ОФВ1 к форсированной жизненной емкости легких и максимальный среднеэкспираторный поток достоверно отражают тяжесть бронхиальной астмы и эффективность терапии. Тест с физической нагрузкой может проводиться с помощью тредмила или обычного бега в течение 6 мин.
Лечение тяжелой формы бронхиальной астмы
При неадекватном контроле бронхиальной пстмы дозу ИГКС увеличивают до эквивалентной 800 мкг беклометазона дипропионата. При необходимости дальнейшего увеличения дозы показана консультация специалиста. Высокие дозы ИГКС имеют преимущество перед пероральными ГКС по отношению эффективность/безопасность. При тяжелой бронхиальной астме может потребоваться регулярное использование пероральных ГКС (ежедневно или через день). Необходимо регулярно оценивать контроль бронхиальной астмы, а при достижении эффекта следует уменьшить дозу. Тяжелая бронхиальная астма нечасто встречается у детей, и при ее наличии необходимо проводить тщательную дифференциальную диагностику и оценивать комплайнс к терапии.
Лечение бронхиальной астмы у детей в возрасте до 2 лет
Эта группа наиболее трудна для диагностики и лечения в связи с ограниченной доказательной базой.
- Диагноз бронхиальной астмы возможен, если зарегистрировано более 3 эпизодов обратимой бронхообструкции в течение предыдущих 6 мес.
- Эпизодический прием β2-агонистов (ингаляционно, через небулайзер или перорально) служит терапией первого выбора, хотя данные противоречивы.
- АЛР используются для ежедневной контролирующей терапии при обструкции на фоне вирусной инфекции (длительное или кратковременное лечение).
- ИГКС через небулайзер или дозированный аэрозольный ингалятор со спейсером применяются в качестве ежедневной контролирующей терапии при персистирующей бронхиальной астме, особенно тяжелой или требующей частых курсов пероральных ГКС.
- Наличие аллергии снижает порог для использования ИГКС, и они могут быть использованы в таких случаях как терапия первой линии.
- Пероральные ГКС (преднизолон 1–2 мг/кг) применяют в течение 3–5 дней при острых и частых рецидивирующих эпизодах бронхообструкции.
- АЛР уменьшают частоту симптомов бронхиальной астмы у детей в возрасте 2–5 лет, и есть некоторые доказательства, что АЛР могут быть эффективны и у детей младше 2 лет.
Как показано в небольших исследованиях, при лечении будесонидом через небулайзер дети с легкой персистирующей или тяжелой бронхиальной астмой имели меньше дневных и ночных симптомов, а также обострений. Однако в других исследованиях продемонстрировано, что использование ИГКС в раннем детстве не влияет на течение бронхиальной астмы или развитие обструкции в последующие годы.
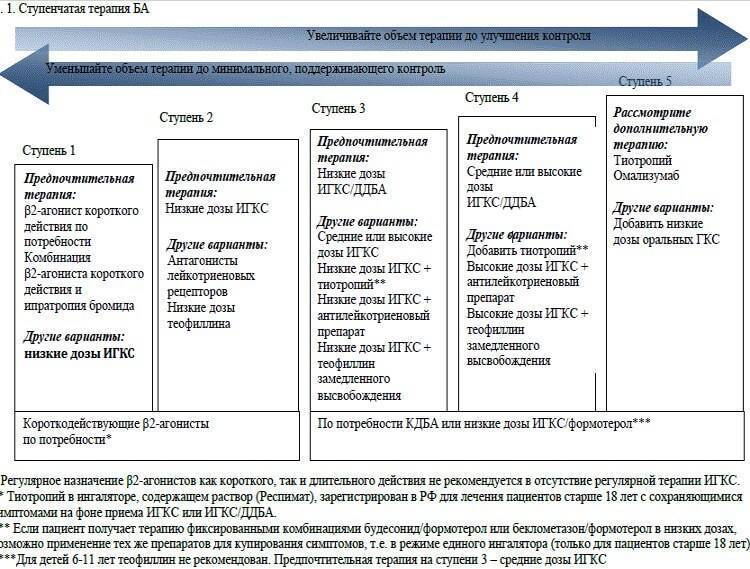
Лечение бронхиальной астмы у детей в возрасте 3–5 лет
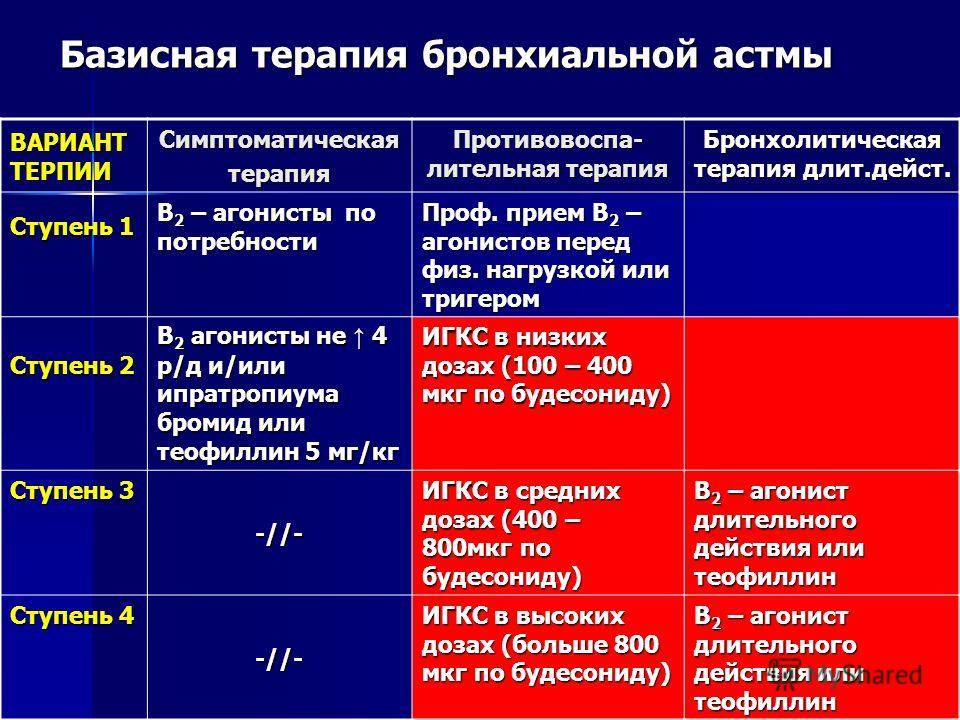
Первая линия терапии у детей с интермиттирующей и персистирующей бронхиальной астмы включает ИГКС и АЛР. Ступенчатая терапия выглядит следующим образом:
- ИГКС – препараты первого выбора (будесонид 100–200 мкг 2 раза в день или флутиказона пропионат 50–125 мкг 2 раза в день через дозированный аэрозольный ингалятор);
- β2-агонисты КД по потребности (сальбутамол 100 мкг или тербуталин 250 мкг по 1–2 дозы с интервалом 4 ч);
- АЛР могут быть использованы как монотерапия вместо ИГКС при интермиттирующей и легкой персистирующей БА;
- если с помощью ИГКС полный контроль бронхиальной астмы не достигнут, добавить АЛР монтелукаст 4 мг/сут (в гранулах или в жевательных таблетках);
- если контроль БА не достигается, обсудить следующие действия (не в порядке применения): добавить β2-агонисты ДД (по крайней мере эпизодически, хотя пока недостаточно данных, поддерживающих их использование в данной возрастной группе), повысить дозу ИГКС, добавить теофиллин.
Патофизиология бронхиальной астмы
Бронхиальная астма отличается особой сложностью у детей, поскольку несколько элементов иммунной системы, включая презентацию антигена, функцию Т-клеток и продукцию антител, являются незрелыми, что предрасполагает к развитию атопического ответа. Взаимодействия между созреванием иммунной системы и развитием легких в первые годы жизни, по-видимому, являются решающим фактором в возникновении бронхиальной астмы.
Иммунологические нарушения при бронхиальной астме
Иммунные реакции могут иметь ряд отличий у детей с бронхиальной астмой, вызванной различными триггерами (например, при аллергениндуцированной и вирусиндуцированной бронхиальной астме), кроме того, особенности течения бронхиальной астмы могут быть обусловлены возрастными изменениями.
Долгое время для объяснения иммунологических нарушений при бронхиальной астме использовали гипотезу о том, что развитие заболевания обусловлено простым смещением баланса между цитокинами Th1- и Th2-лимфоцитов. Тем не менее становится всё более очевидным, что взаимодействия между популяциями Т-клеток и их цитокинами более сложные и существенно различаются (в частности, в зависимости от возраста и природы стимула).
У большинства детей с бронхиальной астмой есть атопия, определяемая как предрасположенность к выработке IgE и возникновению соответствующих клинических симптомов. Хотя атопический фенотип часто присутствует и в грудном возрасте, он становится совершенно явным в дошкольном и школьном возрасте и остается связанным с бронхиальной астмой у пациентов любого возраста. У пациентов с атопией отмечается склонность к повышению уровня IgE в крови и дисбалансу Th2/Th1-клеток при ответе на митогены, аллергены и вирусы. Наличие атопии способствует дальнейшей сенсибилизации к аллергенам и нарушениям ответа на вирусные инфекции.
Структурно-функциональные изменения при бронхиальной астме
В дополнение к воспалению в дыхательных путях при бронхиальной астме развиваются и структурные изменения. Эти изменения могут сохраняться более чем 6 лет даже при отсутствии клинических симптомов и после прекращения лечения бронхиальной астмы.
Термином “ремоделирование дыхательных путей” описывают хронические, возможно необратимые изменения, которые развиваются у больных бронхиальной астмой. Они включают гипертрофию гладкомышечных элементов, ангиогенез и гиперваскуляризацию, хроническую инфильтрацию воспалительными клетками, гиперплазию слизистых желез, отложение коллагена, утолщение базальной мембраны и снижение эластичности стенок дыхательных путей. Такие изменения были выявлены и у взрослых, и у детей, хотя у детей они выражены в меньшей степени. Наличие ремоделирования было подтверждено у детей со свистящим дыханием после вирусной инфекции, но есть доказательства того, что оно не развивается у детей раннего возраста. Ремоделирование может усиливаться элементами Th2-иммунного ответа. Раннее лечение (начиная с возраста 2–3 года) ингаляционными ГКС (ИГКС) не влияет на динамику этих изменений.
Бронхиальное воспаление – ключевая характеристика у большинства пациентов с бронхиальной астмой; оно включает изменения эпителия, приток воспалительных клеток и продукцию большого числа медиаторов. Воспаление тесно связано с гиперреактивностью дыхательных путей. Клеточный состав и другие характеристики зависят от триггера и возраста и могут отличаться при различных фенотипах бронхиальной астмы. Воспаление может персистировать в различной степени в периоды между обострениями.