Диагностика сепсиса
Чтобы правильно установить диагноз, нужно придерживаться определённого алгоритма, предположить наличие болезни, выявить возбудителя и оценить степень поражения внутренних органов.
В связи с отсутствием у новорождённых первичного инфекционного очага, первые проявления сепсиса легко спутать с другими распространёнными заболеваниями. Дыхательные расстройства, поражения желудочно-кишечного тракта часто «маскируют» сепсис.
Для выявления раннего сепсиса в первые 6 дней жизни малыша стоит обратить внимание на вероятные симптомы:
- тяжёлое состояние крохи, выраженная интоксикация;
- температура тела более 37,5 °С или менее 36,2 °С в течение трёх суток;
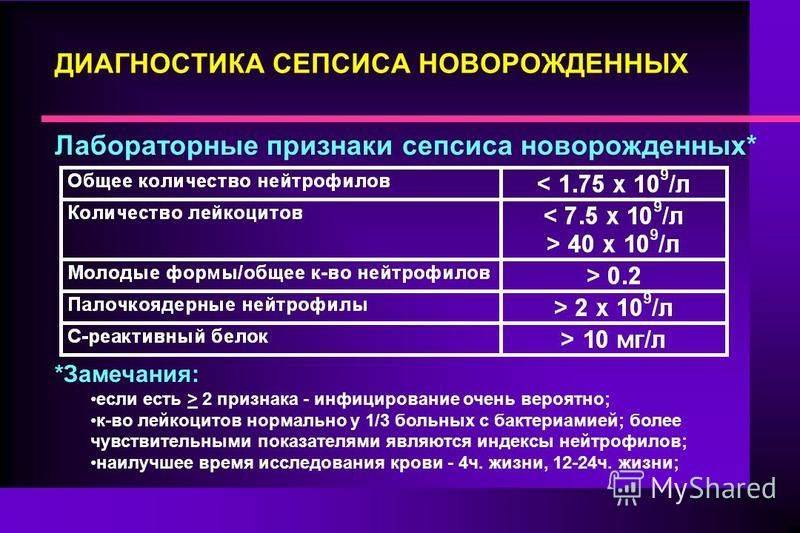
- изменения клинического анализа крови – повышение количества лейкоцитов и снижение уровня тромбоцитов;
- высокий уровень С-реактивного белка;
- повышение количества прокальцитонина и ИЛ-8 в сыворотке крови.
Если признаки сепсиса возникли после 6 дня жизни крохи, то для постановки диагноза необходимо выявление первичного воспалительного очага и изменений лабораторных показателей крови.
Для дальнейшей диагностики и определения наиболее эффективного лечения проводят:
анализ крови на стерильность.
Хотя выявление бактерий в крови может встречаться при различных инфекционных заболеваниях, этот анализ помогает подобрать наилучшее лечение, выбрать самые эффективные препараты, антибиотики;
микробиологическое исследование.
Для выявления возбудителя инфекции исследуется отделяемое из гнойно-воспалительного очага. Возможно микробиологическое исследование, посев на питательную среду и другого материала – гноя, спинномозговой жидкости, мочи (в зависимости от поражённого органа);
лабораторные и инструментальные методы обследования.
Другие исследования применяются для определения степени функционального и структурного поражения всех жизненно важных органов.
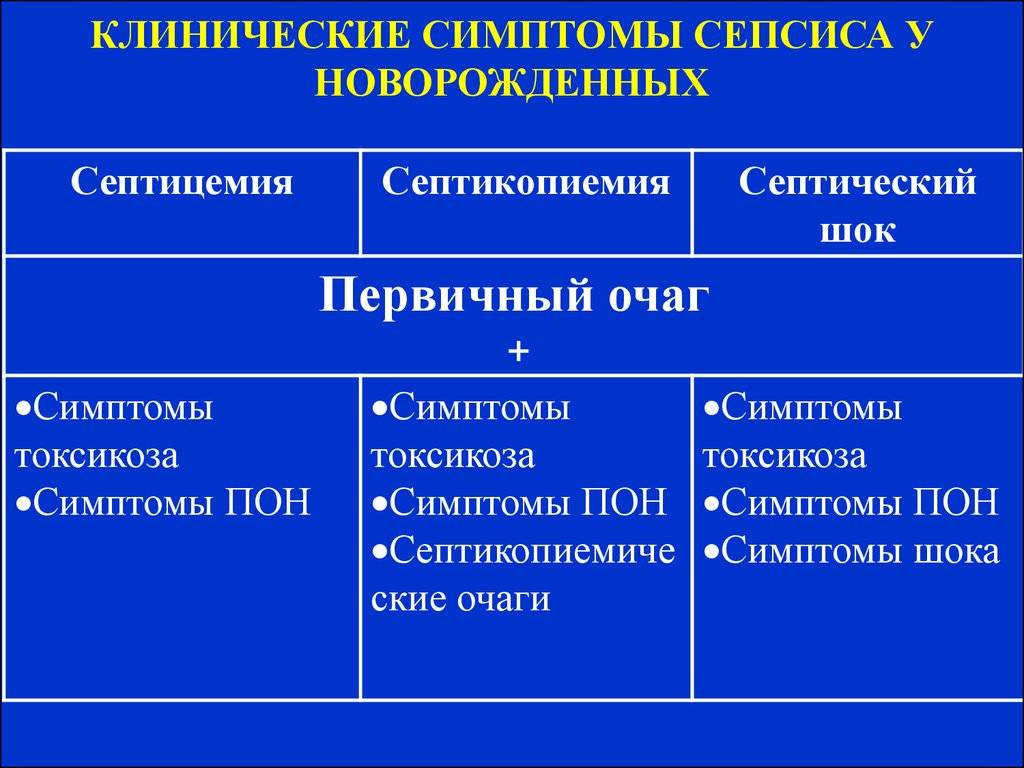
Клинические формы сепсиса новорождённых
Данная форма более характерна для раннего неонатального сепсиса и проявляется наличием возбудителя в крови ребёнка, тяжёлым состоянием крохи, выраженными явлениями интоксикации. Особенность септицемии заключается в поражении внутренних органов без образования гнойных очагов;
септикопиемия.
При развитии септикопиемии возбудитель проникает в различные органы и образует в них гнойные очаги. Данная форма болезни чаще встречается при позднем сепсисе, возникшем не ранее 7 дня жизни крохи.
Отличается сепсис и в зависимости от течения болезни:
- при молниеносной форме заболевание может протекать быстро, состояние малыша в таком случае ухудшается на глазах. Длительность болезни не превышает недели, в течение которой микроорганизм успевает проникнуть во все органы и системы;
- острый сепсис длится от 1 до 2 месяцев, подострый – до 3 месяцев, а затяжной протекает более 3 месяцев. Возможно развитие хронического течения болезни, длящейся до года и рецидивирующего варианта с чередованием периодов улучшения и ухудшения состояния малыша.
Хотя проявления сепсиса отличаются в зависимости от формы и течения болезни, при любом варианте существуют общие клинические проявления, характерные симптомы сепсиса.
Лечение сепсиса новорожденных
В качестве лечения используют:
- антибиотики;
- симптоматическую (поддерживающую) терапию.
Сепсис опасен для жизни ребёнка, так как быстро разрушает его организм, поэтому лечение антибактериальными препаратами следует начинать как можно быстрее, с последующей корректировкой в соответствии с чувствительностью микроорганизмов к ним. Бывает так, что причина инфекции остаётся невыясненной, ребёнок внешне здоров, а анализы показывают отрицательные результаты бакпосевов. В таких случаях антибиотики вводят согласно установленным схемам в течение 48 часов, после чего лечение можно прекратить. Если масса тела ребёнка низкая, длительность лечения должна составлять 72 часа.
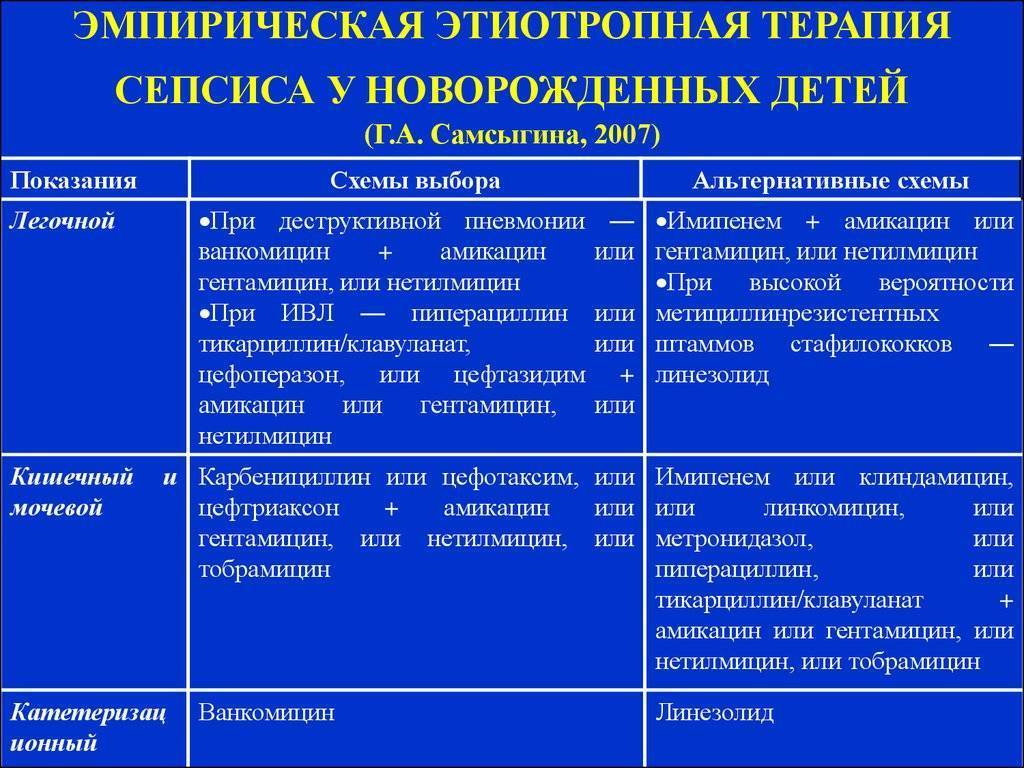
Обычно стартовую терапию лечения сепсиса начинают с аминогликозида и ампициллина, применяемых совместно. Иногда целесообразно добавление цефотаксима или его полная замена аминогликозидами в случае подозрения менингита, вызываемого грамотрицательными микроорганизмами. Замену антибиотиков, если она необходима, проводят после точного выявления возбудителя инфекции.
Здоровым детям из группы новорождённых, где находился больной ребёнок, тоже назначают антибиотики в виде комбинации гентамицина с ампициллином либо ампициллина с цефотаксимом. Если речь идёт о позднем варианте внутрибольничного сепсиса, в рамках стартовой терапии детям назначают ванкомицин.
Если ребёнок раньше уже прошёл курс лечения аминогликозидами от 7 дней до 2-х недель и нуждается в повторной терапии, нужно рассматривать другие антибактериальные препараты, относящиеся к аминогликозидам или цефалоспоринам третьего поколения.
При применении постоянных венозных катетеров есть риск инфицирования коагулазонегативным стафилококком. В данной ситуации стартовую терапию сепсиса следует начинать с ванкомицина, но если обнаружена чувствительность микроорганизма к нафциллину, препарат заменяют нафциллином либо цефазолином. Безусловно, катетер необходимо удалить. Также следует учитывать то, что при взятии анализа на бакпосев грибковые структуры проявляют себя в течение двух-трёх дней. Нужно быстро начать эмпирическое лечение амфотерицином В ещё до того как будет получен результат анализа, так как именно это может спасти жизнь новорождённого.
Симптомы сепсиса новорожденных
Первые симптомы сепсиса являются практически одинаковыми и не зависят от того, какой вид возбудителя их вызывает:
- ребёнок плохо сосёт;
- плохо ест;
- у него снижена частота сердечных сокращений;
- проблемы с дыханием вплоть до остановок;
- температура тела может колебаться от гипотермии до высоких цифр.
Возникновение лихорадочного состояния наблюдают в 10-15% клинических случаев. Если лихорадка держится в течение длительного времени (час и более), инфицирование, скорее всего, очевидно. К другим ранним проявлениям сепсиса, которые должны побудить врачей к принятию экстренных мер, относят судорожные состояния, желтушность кожных покровов, рвоту, расстройства кишечника.
Ранний сепсис, вызванный В-стрептококком, часто проявляется у новорождённых быстротечными формами воспаления лёгких. При позднем начале сепсиса (период может составлять до 12 недель), частота возникновения менингита очень высока.
Патофизиология и факторы риска
Есть ряд перинатальных и акушерских факторов, увеличивающих риск возникновения сепсиса новорождённых. Это преждевременный разрыв околоплодных оболочек (или ПРПО), симптомы которого проявляются примерно за 17-18 часов до рождения ребёнка. Также к факторам риска относят и хориоамнионит у матери. Он может начаться как в процессе родов, так и незадолго до них – с симптоматикой материнского лейкоцитоза, болезненностью матки, выделениями с неприятным запахом и тахикардией. При колонизации В-стафилококками риск возникновения сепсиса повышается в несколько раз.
Известно, что у матерей, имеющих низкую плотность колонизации стафилококками группы В, часто рождаются дети, колонизация у которых, наоборот, имеет высокую плотность. В околоплодных водах содержатся меконий и смазка. Их среда провоцирует интенсивный рост и развитие микроорганизмов (в частности, разных видов стрептококков). Если происходит преждевременный разрыв оболочек плода, патогенная микрофлора начинает усиленно размножаться. Аспирация способствует её попаданию в кровоток ребёнка, в результате чего быстро развивается бактериемия.
При позднем начале сепсиса новорождённых в качестве основного фактора риска следует отметить роды, начавшиеся преждевременно. К другим фактором относят использование внутрисосудистых катетеров, наличие ассоциированных патологий, действие некоторых антибактериальных препаратов и длительное нахождение в условиях стационара.
Грамположительные виды стафилококков попадают в организм ребёнка из внешней среды либо с кожных покровов. Грамотрицательная кишечная палочка, как правило, находится в эндогенной микрофлоре и начинает проявлять себя в условиях изменения внутренней среды организма: например, микрофлора может меняться при приёме антибиотиков или попадании резистентных бактерий. Резистентные бактерии могут оказаться внутри организма ребёнка, как минимум, двумя путями:
- через контаминированное медицинское оборудование;
- через руки медицинского персонала при некачественной обработке.
Грибковая флора, способствующая развитию сепсиса, попадает в кровь при длительном применении катетеров центрального типа, а также при регулярном перекармливании и применении некоторых антибиотиков цефалоспориновой группы.
Диагностика: признаки сепсиса у детей
Этим заболеванием, по данным ВОЗ, каждый год болеет не менее трех миллионов детей и 1.2 млн новорожденных. Недуг почти всегда сопровождается жаром, дыхательной недостаточностью, дисфункцией сердечно-сосудистой системы и других органов.
У детей все процессы скоротечны, поэтому есть ряд признаков, на которые надо обратить внимание родителям. Итак, каковы симптомы сепсиса у детей?
- слабость;
- увеличение частоты дыхания;
- кашель при воспалении легких;
- боли в спине при пиелонефрите;
- лихорадка с температурой выше 38,3°С;
- учащение пульса до 160 ударов в минуту;
- нарушения моторики ЖКТ с тошнотой и рвотой;
- снижение температуры тела ниже 36°С
Если вовремя не диагностировать сепсис крови у ребенка, то может наступить и летальный исход от септического шока.
Диспансеризация и реабилитация детей, перенесших сепсис
На диспансерном учете дети находятся в течение 12 месяцев. Диспансерное наблюдение включает:1) осмотр врачом ребенка ежемесячно до года с момента выписки из стационара;2) консультация узких специалистов – лор-врача, невролога, по показаниям – иммунолога;3) анализ крови и мочи – через месяц после выписки из стационара, затем 1 раз в 3 месяца, при частых заболеваниях – иммунограмма;4) лечебно-оздоровительные мероприятия (3–4 недели): назначение неспецифических стимуляторов иммунитета –дибазола, элеутерокоак, карнитина хлорида, апилака – курсом до 2–3 недель; назначение витаминов А, Е, С, В6, оротата калия, фолиевой кислоты – курс 10–14 дней; при неустойчивом стуле – применение эубиотиков с исследованием на дисбактериоз; при церебральных нарушениях – препаратов, улучшающих метаболические процессы и кровообращения в ЦНС:ноотропил, пирацетам, пикамилон, фенибут, пантогам, глицин, актовегин, танакан, трентал; гимнастика, массаж, закаливание; контроль за физическим развитием; профилактические прививки через 6 месяцев после выздоровления.
Лечение бактериального сепсиса новорожденного
Проводится комплекс лечебных мероприятий, которые включают проведение гигиенических мероприятий, правильное вскармливание новорожденного, этиотропную терапию и патогенетическое лечение, направленное на восстановление гемостаза и повышение иммунной защиты организма. Ведущее значение имеет борьба с инфекцией. С этой целью используют антибиотики или комбинацию антибактериальных препаратов с бактерицидным действием, способных проникать через гематоэнцефалический барьер. Коррекция гуморального иммунитета проводится с помощью иммунозаместительной терапии препаратами иммуноглобулинов (пентаглобин). При нарушении клеточного иммунитета назначается рекомбинантный интерлейкин-2. Применяется инфузионная терапия, позволяющая восполнить объем циркулирующей крови и восстановить баланс электролитов.
Основные лекарственные препараты
Имеются противопоказания. Необходима консультация специалиста.
- Цефепим (антибактериальное средство из группы цефалоспоринов IV поколения). Режим дозирования: у детей от 2 мес. до 16 лет и с массой тела до 40 кг рекомендуемый режим дозирования по всем показаниям (исключая фебрильную нейтропению) — 50 мг/кг каждые 12 ч внутривенно; при фебрильной нейтропении — 50 мг/кг каждые 8 ч. Продолжительность лечения как у взрослых.
- Амикацин (антибиотик группы аминогликозидов). Режим дозирования: недоношенным новорожденным начальная доза внутривенно — 10 мг/кг, затем по 7,5 мг/кг каждые 18-24 ч; новорожденным начальная доза — 10 мг/кг, затем по 7,5 мг/кг каждые 12 ч в течение 7-10 дней.
- Ванкомицин (антибиотик группы гликопептидов). Режим дозирования: для новорожденных начальная доза должна составлять 15 мг/кг, а затем 10 мг/кг каждые 12 ч в течение первой недели их жизни. Начиная со второй недели жизни — каждые 8 ч до достижения возраста одного месяца. Каждую дозу следует вводить в течение не менее 60 мин.
- Имипенем + Циластатин (Гримипенем) – антибиотик: карбапенем + почечной дегидропептидазы блокатор). Режим дозирования: вводится в/в капельно. У детей, начиная с 3-месячного возраста, с массой тела до 40 кг, разовая доза внутривенно составляет 15 мг/кг, которую вводят каждые 6 часов. Максимальная суточная доза составляет 2 г.
- Линезолид (антибактериальное средство из группы оксазолидонов). Режим дозирования: препарат предназначен для внутривенного введения. Продолжительность инфузии составляет 30-120 мин. Режим дозирования и продолжительность лечения зависят от возбудителя, локализации и тяжести инфекции, а также от клинической эффективности.
Рекомендуемый режим дозирования Линезолидом для детей младше 12 лет
| Показания (включая инфекции, сопровождающиеся бактериемией) | Разовая доза и кратность введения | Рекомендуемая продолжительность лечения |
| Внебольничная пневмония, вызванная Streptococcus pneumoniae (включая полирезистентные штаммы), включая случаи, сопровождающиеся бактериемией, или Staphylococcus aureus (только метициллинчувствительные штаммы) | 10 мг/кг каждые 8 ч | 10-14 дней |
| Госпитальная пневмония, вызванная Staphylococcus aureus (включая метициллинчувствительные и метициллинрезистентные штаммы) или Streptococcus pneumoniae (включая полирезистентные штаммы) | 10 мг/кг каждые 8 ч | 10-14 дней |
| Осложненные инфекции кожи и мягких тканей, включая инфекции при синдроме диабетической стопы, не сопровождающиеся остеомиелитом, вызванные Staphylococcus aureus (включая метициллинчувствительные и метициллинрезистентные штаммы), Streptococcus pyogenes или Streptococcus agalactiae | 10 мг/кг каждые 8 ч | 10-14 дней |
| Инфекции, вызванные штаммами Enterococcus faecium, резистентными к ванкомицину, в том числе сопровождающиеся бактериемией | 10 мг/кг каждые 8 ч | 14-28 дней |
Лечение сепсиса у детей
ВАЖНО! Лечение проводится только в условиях стационара!
Лечение сепсиса комплексное, включает массивную антибактериальную или противогрибковую терапию, дезинтоксикационную терапию. Должно проводиться в условиях отделения интенсивной терапии. В некоторых случаях может потребоваться переливание компонентов крови.
Прогноз при любой форме данного заболевания всегда серьезен. Чем раньше начато лечение, тем выше вероятность полного выздоровления. Сложность диагностики и лечения инфекции заключается в наличии большого количества стертых форм, когда клиническая картина не столь яркая.
Поэтому при лечении применяются антибактериальные препараты широкого спектра действия. Кроме того, в состав комплексной терапии могут быть включены и противовирусные и иммуномодулирующие препараты. Препарат ВИФЕРОН Свечи разрешен для применения у детей с первых дней жизни, в том числе недоношенным малышам. При комплексной терапии сепсиса рекомендуемая доза для новорожденных детей, в том числе недоношенных с гестационным возрастом более 34 недель ВИФЕРОН 150000 МЕ ежедневно по 1 суппозиторию 2 раза в сутки через 12 ч. Курс лечения – 5 суток.
Недоношенным новорожденным детям с гестационным возрастом менее 34 недель рекомендовано применение препарата ВИФЕРОН 150000 МЕ ежедневно по 1 суппозиторию 3 раза в сутки через 8 ч. Курс лечения – 5 суток.
Рекомендуемое количество курсов при сепсисе – 2-3 курса.
Благодаря своему уникальному составу, препарат Виферон помогает не только поддержать иммунную систему пациента и блокировать размножение вирусов, но и снизить дозу антибактериальных препаратов и уменьшить интоксикацию организма.
2.Причины и факторы риска
Бактериальные инфекции являются самой частой причиной сепсиса. Но сепсис может развиться и из-за других инфекций. Инфекция может начаться в любом месте – там, где бактерии или другие инфекционные агенты могут попасть в организм. Заражение крови может стать как результатом безобидной, на первый взгляд, царапины, так и следствием серьезной медицинской проблемы – аппендицита, пневмонии, менингита или инфекции мочевыводящих путей. Сепсис может появиться при инфекциях костей – остеомиелите.
Теоретически сепсис может развитья у любого человека. Но часть людей подвергается повышенному риску развития сепсиса. Среди них:
- Люди, чья иммунная система плохо функционирует из-за таких заболеваний, как ВИЧ/СПИД или рак. В эту же группу входят пациенты, для лечения которых используются наркотические препараты, подавляющие иммунную систему (например, для предотвращения отторжения пересаженных органов).
- Младенцы.
- Пожилые люди, особенно если у них есть проблемы со здоровьем.
- Госпитализированные в стационар пациенты, в том числе, которым делались инвазивные медицинские процедуры. По статистике, распространенными зонами первичной инфекции при сепсисе являются хирургические разрезы, мочевые катетеры и пролежни.
- Пациенты с сахарным диабетом.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Этиология
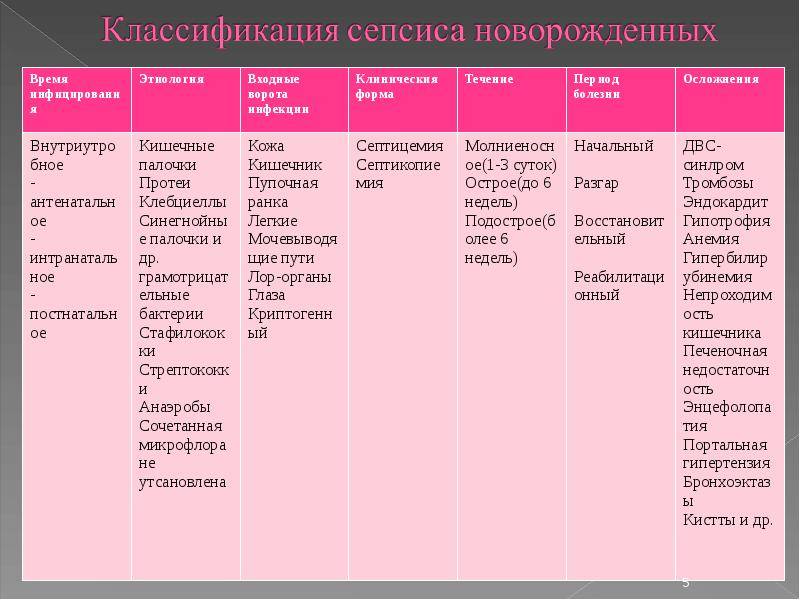
Этиологическая структура сепсиса постоянно претерпевает изменения. При сепсисе, начинающемся в пер-вые 4 дня жизни (раннем), в 40% случаев возбудителями являются стрептококки группы В, Е, энтерококки (стрептококки D), в 4–15% – анаэробы, коагулазо-отрицательный стафило-кокк, а также клебсиеллы, кишечная палочка, т.е. бактериальная флора, колонизирующая родовые пути матери. Для позд-него сепсиса (4–5-й день жизни и более) характерна грамотрицательная флора (клебсиеллы, синегнойная палочка, серрация, энтеробактер, эшерихии), хотя в последние годы вновь возросла роль стафилококков (золотистый, эпидермальный,варнерии) как этиологического фактора. У 50% больных обнаруживается сочетанная (микст) флора, например стафилококки и грамотрицательные бактерии.На сегодняшний день, согласно МКБ Х пересмотра, не выделяют кандида сепсис (микоза), считая, что он является вторичным, и рассматривают его как самостоятельную нозологическую единицу, используя термин «генерализованная кандидозная инфекция».Установление этиологического фактора является обязательным, так как этиология заболевания обусловливает клиническую картину болезни, выбор медикаментозной терапии и исход заболевания.Основные источники инфицирования: мать, которая чаще всего инфицирует плод анте- и интранатально; медицинский персонал родильных домов и других лечебных учреждений;окружающая среда.Основные пути инфицирования плода: восходящий, контактный (интранатальный), трансплацентарный (гематогенный), нисходящий (брюшная полость, маточные трубы).В постнатальном периоде инфицирование ребенка происходит гематогенным, лимфогенным, контактным, нисходящим и восходящим путями.Предрасполагающие факторы, способствующие развитию сепсиса, можно подразделить на 2 группы: оказывающие депрессивное воздействие на иммуннуюсистему плода и новорожденного; способствующие его инфицированию.• По времени их воздействия выделяют антенатальные, интранатальные и постнатальные факторы.• Перинатальные факторы, оказывающие депрессивноевоздействие на формирование иммунитета плода и новорожденного: со стороны матери: гестозы, генитальная и экстрагенитальная патология, угроза прерывания беременности, дефекты питания беременной женщины, эндокринная патология; со стороны ребенка: недоношенность, незрелость, холодовой стресс, ЗВУР и врожденная гипотрофия, родовая травма, СДР, ОРВИ, внутриутробная гипоксия плода и асфиксия вродах, нарушение процессов адаптации в раннем неонатальном периоде.
• Анте-, интранатальные факторы, способствующие инфицированию плода и новорожденного: урогенитальная инфекция во время беременности и в родах, раннее отхождениеоколоплодных вод, длительный безводный период (более 6 ч),продолжительность родов более 24 ч, затяжные роды, лихорадка в родах, хронические очаги инфекции и их обострения впериод беременности, инфекционно-воспалительные процессы у матери в послеродовом периоде.• Лечебно-диагностические манипуляции: интубация, лаваж(инстиляция) ТБД, ИВЛ, катетеризация центральных и периферических вен, мочевого пузыря и пр.• Наличие различных очагов инфекции у новорожденных:омфалит, ОРВИ, пневмонии, гнойно-воспалительные заболевания кожи, особенно в первые 7 дней жизни, дисбактериоз.• Ятрогенные факторы, усугубляющие иммунологическиенарушения: гормональная терапия, нерациональная антибактериальная терапия беременных и новорожденных, неадекватное калорийное обеспечение, неэффективность лечебныхмероприятий по коррекции гипоксии, метаболических нарушений.
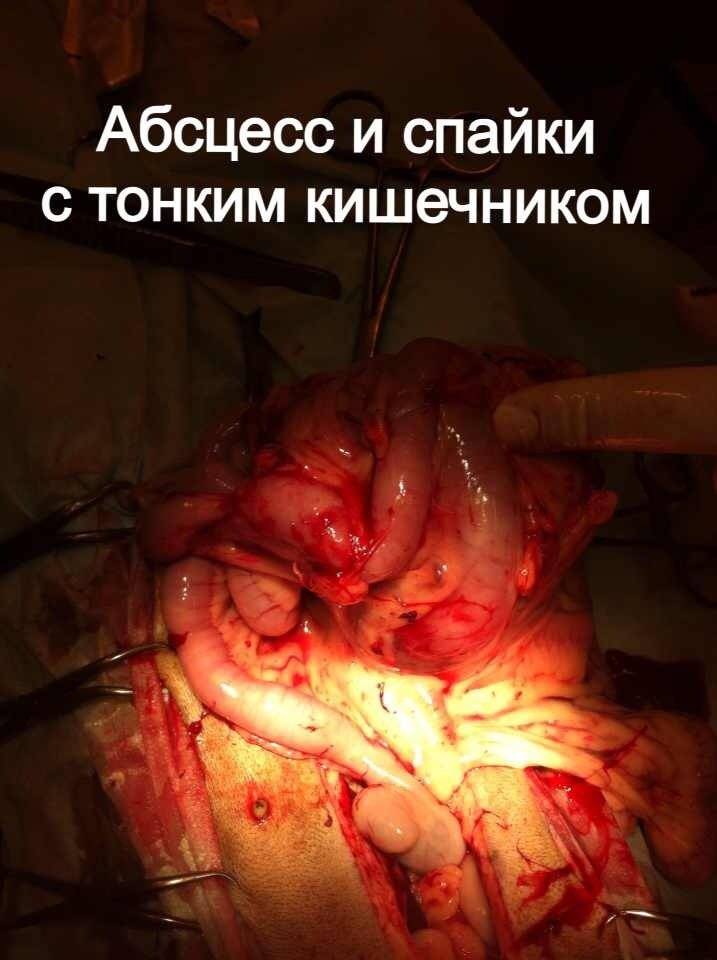
ЛЕЧЕНИЕ ХИРУРГИЧЕСКОЙ ИНФЕКЦИИ.
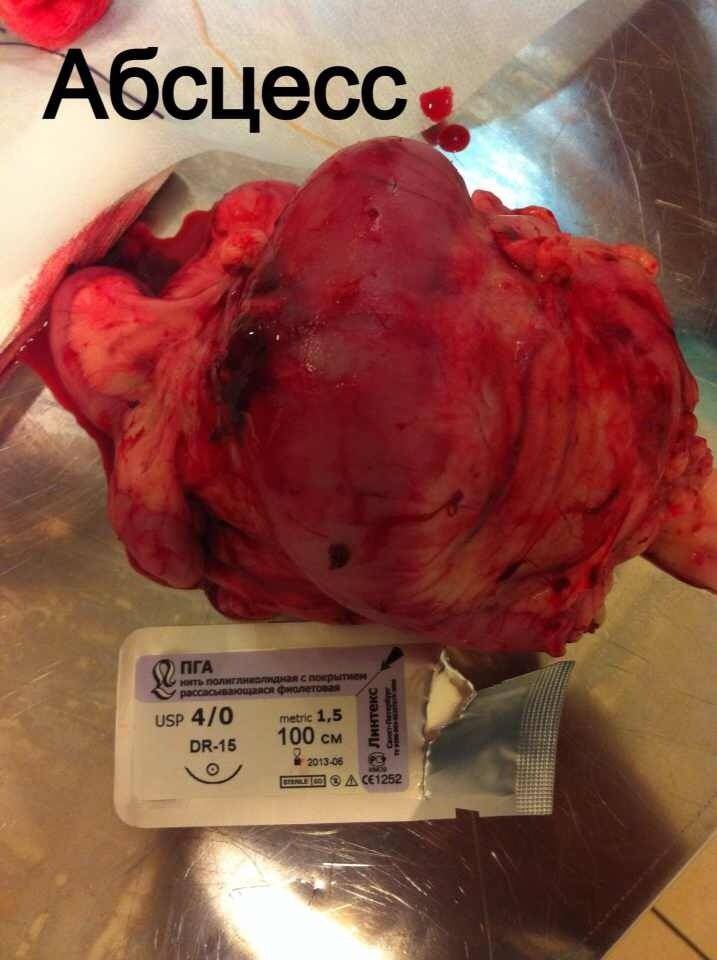
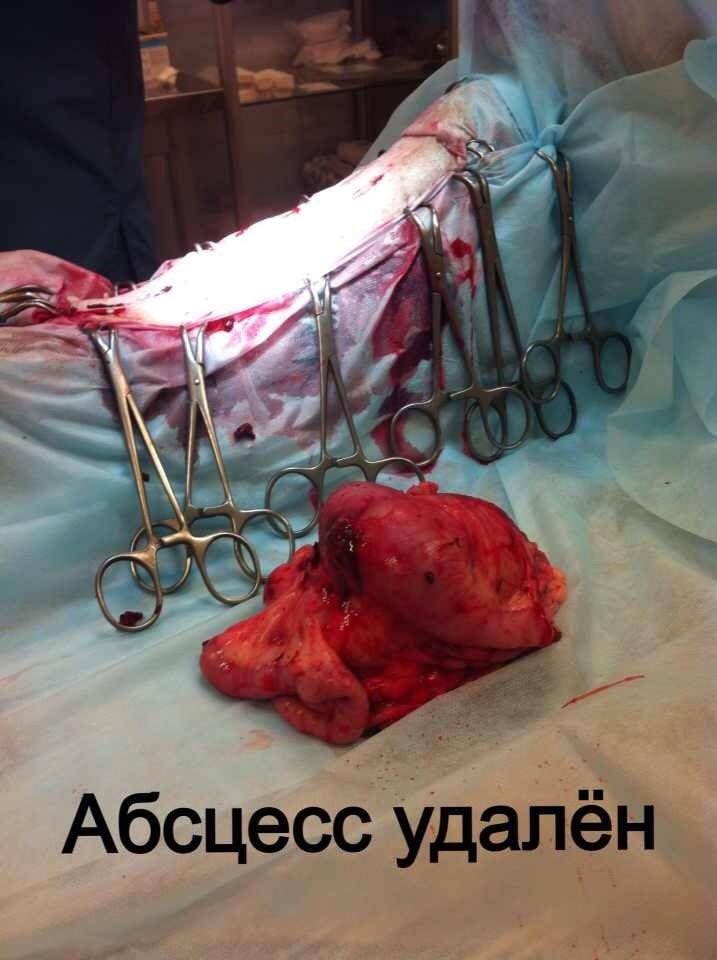
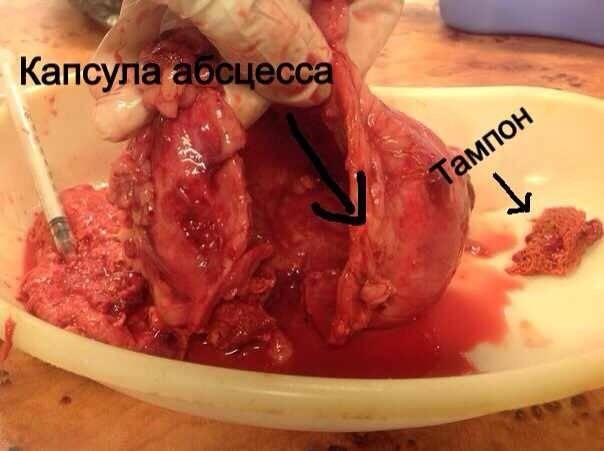
Стационарное лечение является единственным вариантом для животных с сепсисом. При подозрении на септический шок проводят реанимационные мероприятия. Необходимо обеспечить регидратацию (восстановление объема жидкости), обезболивание пациентов, оксигенотерапию, парентеральное и/или энтеральное питание, адекватное обезбливание. После стабилизации общего состояния животного требуется ликвидация первичного очага путем эвакуации гнойного содержимого или полным его иссечением (рис. 10).
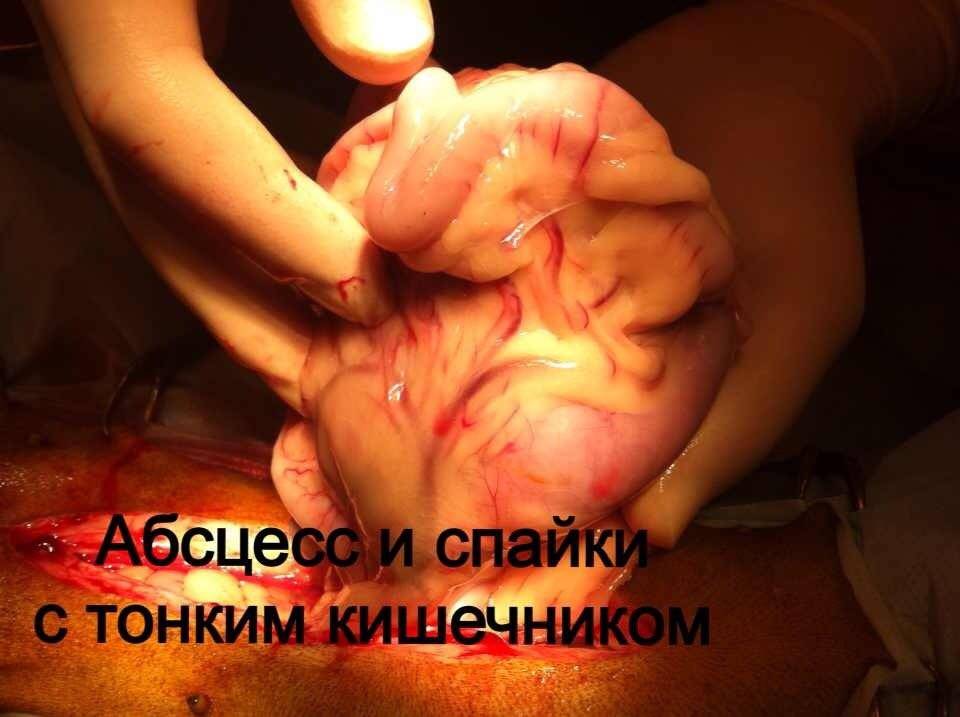
При подозрении на септическое состояние, нередко приходится сначала стабилизировать, по возможности, общее состояние животного. При этом практически всегда проводится коррекция системных нарушений.Лечение носит, в основном, этиологический характер. Желательно определить возбудитель и его чувствительность к антибиотикам. Антимикробные средства должны использоваться в максимальных дозах. Применение антибиотиков следует начинать как можно раньше. Желательно учитывать результаты бактериологических исследований, однако результаты бактериологии мы узнаем не ранее чем через 7 дней. При сепсисе это критическая задержка. Поэтому на практике мы часто вынуждены подбирать антибиотики эмпирически.
Для терапии септического шока необходимо использовать антибиотики, которые перекрывают максимальный спектр грамотрицательных микроорганизмов. Комбинация цефтазидима и имипинема эффективны по отношению к синегнойной палочке. Такие препараты как клиндамицин, метронидазол, тикарциллин или имипинем применяются как медикаменты выбора при возникновении резистентного возбудителя к другим антибиотикам. Если из крови высеяны стафилококки, нужно включать в схему лечения препараты пенициллина.
Лечение гипотонии на первом этапе заключается в адекватности внутрисосудистого объёма. Инфузионная терапия должна включать изотонические кристаллоиды и синтетические коллоиды. Если нет эффекта – то применяют инотропы (усил. сокр. сердца) и вазоконстрикторные (сосудосуживающие) препараты (мы используем допамин). Коррекцию рвоты производят при помощи препаратов:
- Метоклопрамид 1-2 мг/кг каждые 24 часа внутривенно
- Цизаприд 0,5-1 мг/кг перорально каждые 8 часов (но его сложно найти). Мы чаще всего используем препарат «серения» в дозе 0,1 мл/кг подкожно, каждые 24 часа
При тенденции к кровотечениям используется свежезамороженная плазма.Кортикостероиды (по некоторым данным) снижают реакцию макроорганизма на эндотоксины, способствуют ослаблению лихорадки, но их применение остается спорным.Собакам можно применять лидокаин внутривенно. НПВС не должны применяться пока не будет четкой уверенности в нормальной функции ЖКТ, почек, а проблема с гипотонией не будет окончательно решена.
Белов Михаил Викторович, кандидат ветеринарных наук, хирург-ортопед, травматолог Многопрофильной ветеринарной клиники «Перспектива-вет»
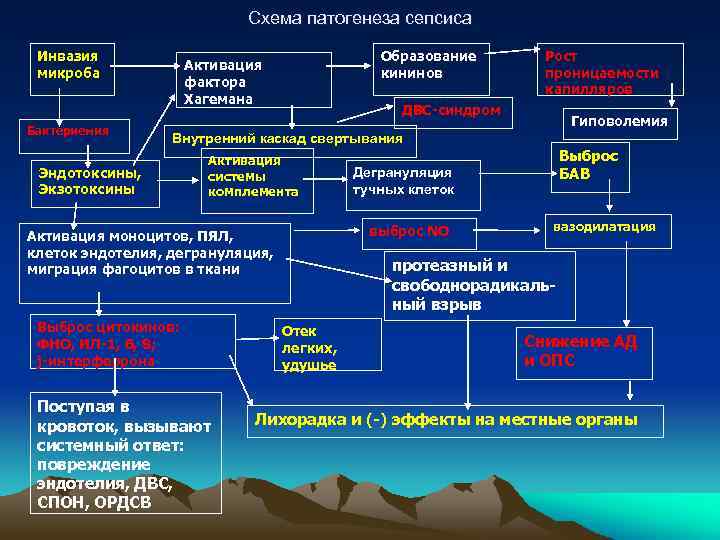
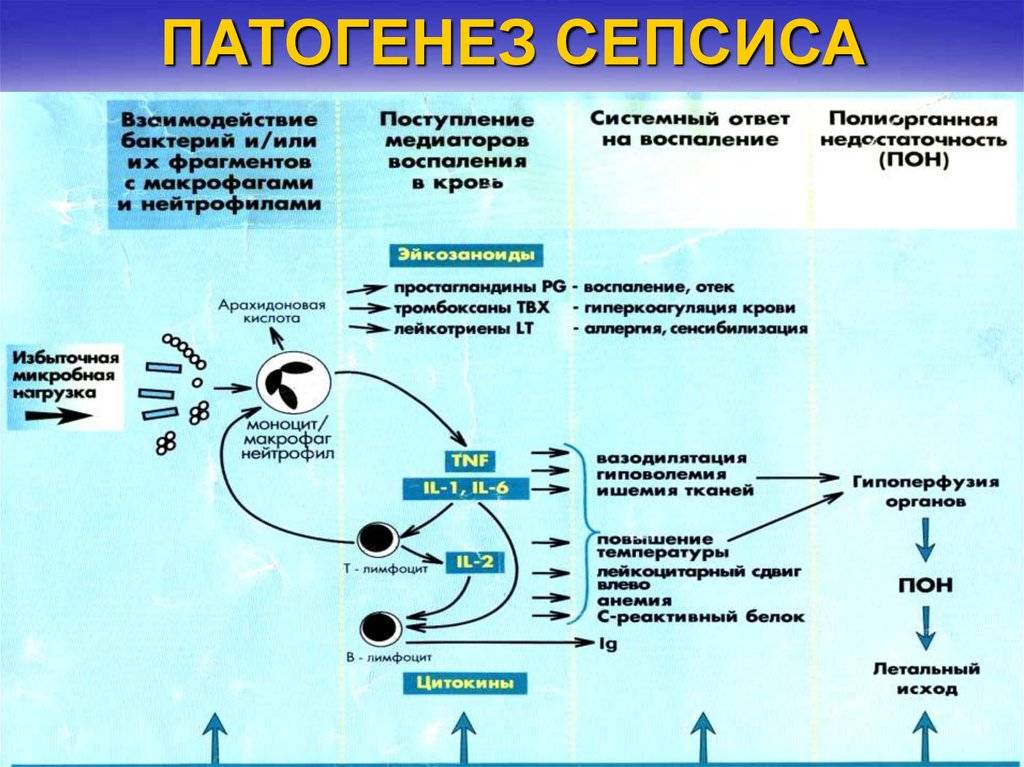
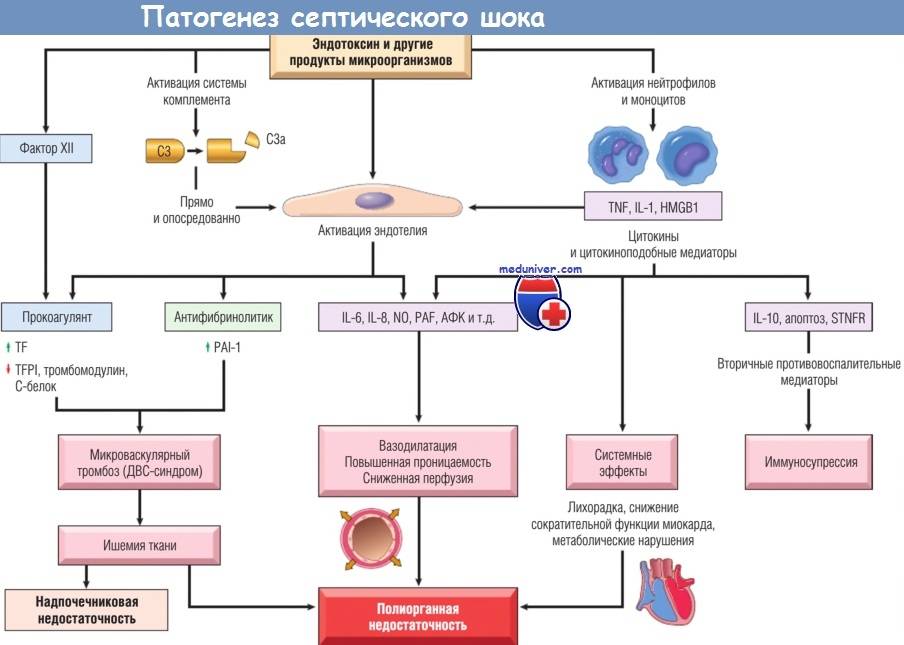
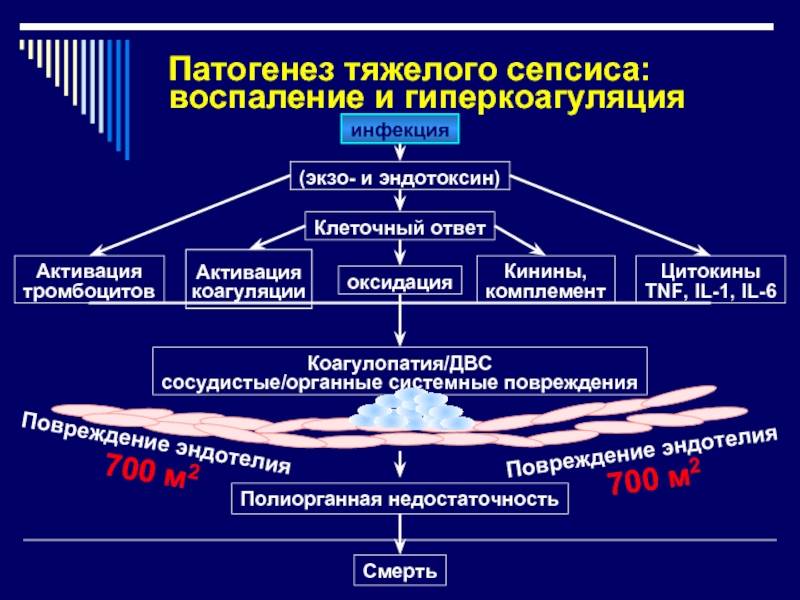
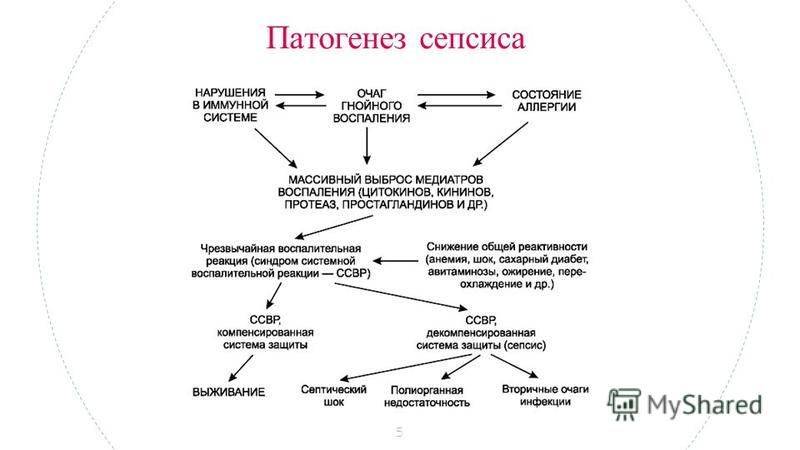
Патогенез
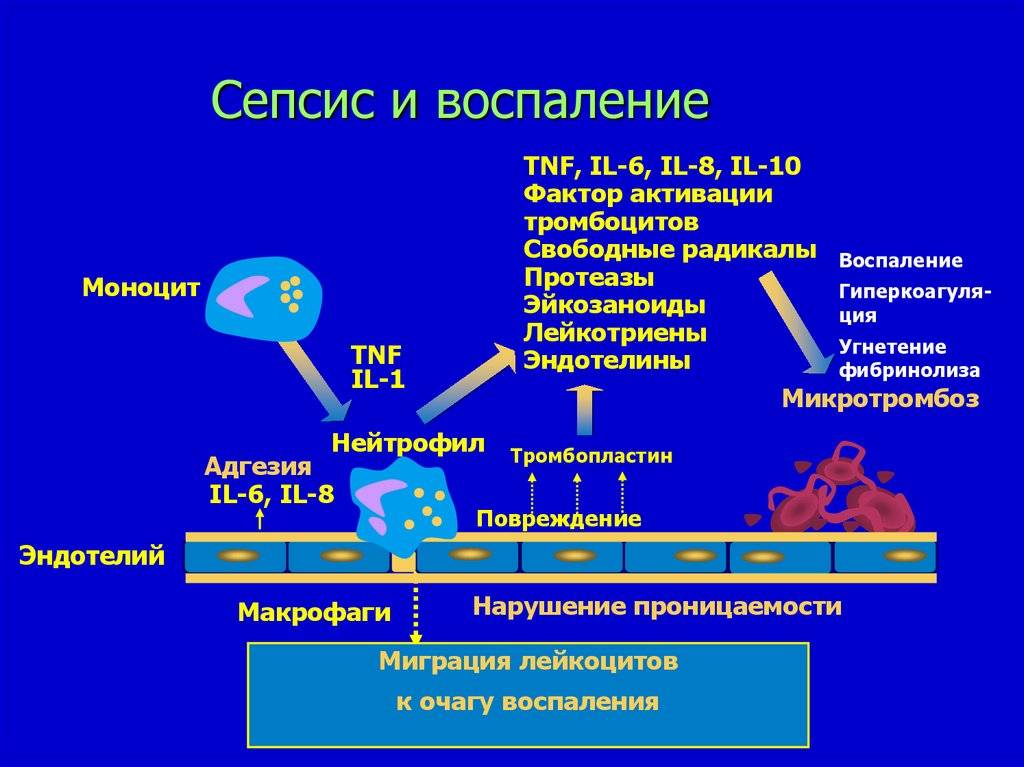
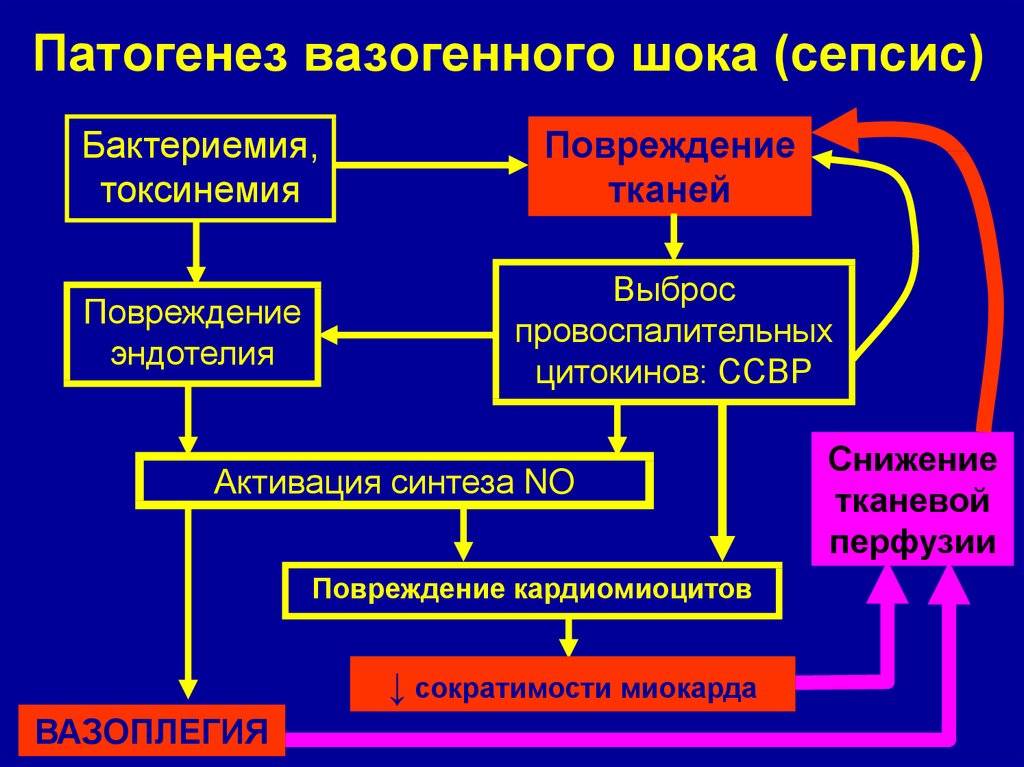
Возникновение сепсиса зависит от 3 факторов: состояния реактивности макроорганизма, т.е. его неспецифической (естественные барьеры – кожа и слизистые, лимфатические узлы, нейтрофилы, комплемент, интерферон, пропердин, лизоцим) и специфической иммунологической реактивности; массивности инвазии и вирулентности возбудителя; особенностей внешней среды.Однако решающее значение в возникновении заболевания принадлежит реактивности макроорганизма, особенно его неспецифическим факторам защиты.На сегодняшний день современная схема патогенеза выглядит следующим образом.Для возникновения септической инфекции необходимовнедрение в организм возбудителя через входные ворота (пупочная область, кожа, слизистые, легкие, кишечник и т.д.).В месте внедрения инфекции возникает местный воспалительный очаг, который характеризуется не столько воспалением, сколько деструкивно-некротическими процессами втканях в силу анатомо-физиологических особенностей, об-условленных концевым типом расположения сосудов и недостаточно развитым сосудистым компонентом воспалительной реакции, что способствует замедлению кровотока и оседанию микроорганизмов с развитием воспаления альтернативно-дегенеративного характера.Незрелость сосудистого компонента воспалительной реакции,повышенная проницаемость барьерных систем, несовершенство регуляции ЦНС в случае массивной инвазии возбудителя приводит к быстро развивающейся бактериемии – титр 10 в 3 степени или 10 в 5 степенив 1 мл крови (при этом сохраняется способность макроорганизма противостоять микробной нагрузке).Выделение бактериями экзо- и эндотоксинов, а также воздействие модулинов (обломки клеточных структур возбудителя) приводит к сенсибилизации и иммунологической перестройке организма новорожденного.
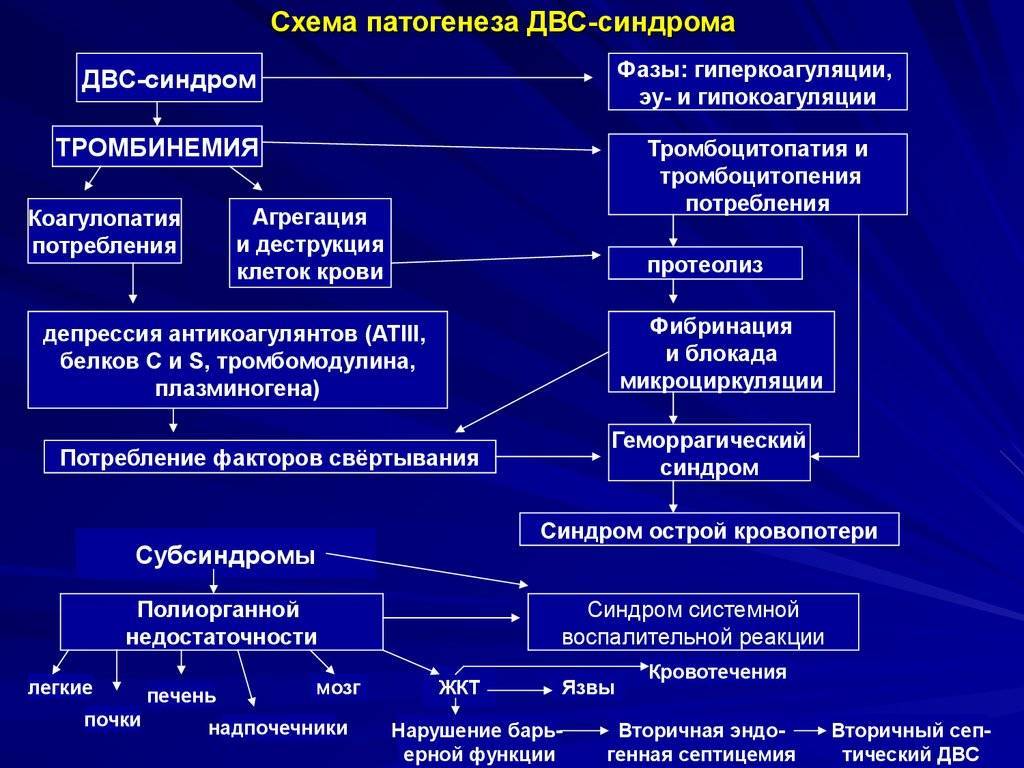
Непрерывное поступление в организм больного ребенка антигенных структур микроорганизма ведет к превалированию активации провоспалительных факторов над активацией противовоспалительных факторов, что запускает патологический процесс, проявляющийся системной воспалительной реакцией организма (SIRS-синдром – ССВО). В ответ на длительную циркуляцию в крови большого количества провоспалительных факторов (цитокинов) увеличивается концентрация противовоспалительных факторов с активацией продуктов катаболизма белков, липидов, углеводов. Их избыток ведет к возникновению феномена эндотоксиновой толерантности моноцитов, инактивации рецепторов ИЛ-1, -2, -6 и ФНО, вследствие чегоони теряют способность реагировать на бактериальные стимулы, что ведет к развитию иммунного паралича организма.Иммунологические сдвиги приводят к спонтанной необратимой генерализации инфекции с развитием септицемии, ко-торая может перейти в следующую форму – септикопиемию.Переизбыток провоспалительных цитокинов («цитокиновый шторм») ведет к кардиоваскулярнрой недостаточности –септическому шоку, коллапсу, существенным изменениямфункций, структур других органов и систем, лактат-ацидозу,стимулированию апоптоза с развитием полиорганной недостаточности и ДВС-синдромома.Тяжесть состояния больного сепсисом в основном обусловлена степенью эндогенной интоксикации.